题目内容
10.下列各溶液中,微粒的物质的量浓度关系正确的是( )| A. | Na2CO3溶液中:2c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 0.1 mol/L Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 向醋酸钠溶液中加入一定量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) |
分析 A、溶液中存在物料守恒分析,钠元素物质的量是碳元素物质的量的2倍;
B、溶液中存在质子守恒分析判断,水电离出的氢离子和氢氧根离子相同;
C、根据电荷守恒分析;
D、pH=5的混合溶液,钠离子、硝酸根离子不电离、不水解.
解答 解:A、溶液中存在物料守恒,Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故A错误;
B、0.1 mol/L Na2CO3溶液中存在质子守恒,水电离出的氢离子和氢氧根离子相同:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故B正确;
C、根据电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液显酸性c(H+)>c(OH-),所以c(Na+)<c(CH3COO-),所以混合溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中c(Na+)=c(NO3-),故D错误;
故选B.
点评 本题考查离子浓度大小的比较,明确盐类水解的应用及质子守恒、电荷守恒即可解答,注意选项D为易错点,题目难度不大.

练习册系列答案
相关题目
15.常温下,100mL 0.1mol•L-1的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,则下列比较中正确的是( )
| A. | HX、HY、HZ的酸性依次增强 | |
| B. | 溶液中的离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 电离常数K(HY)>K(HZ),水解常数K(Y-)>K(Z-) | |
| D. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) |
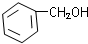
13.NPG的结构式如图,有关NPG说法错误的是( )


| A. | NPG与乙二醇互为同系物 | |
| B. | 1mol该醇与足量的钠反应放出1mol H2 | |
| C. | NPG一定条件下能发生取代反应、酯化反应、氧化反应、加成反应、加聚反应 | |
| D. | 分子式为C5H12O2 |
5.某无色透明的溶液能够与铝作用生成氢气,则在此溶液中一定能大量共存的离子组是( )
| A. | HCO3-、NO3-、Ba2+、Cl- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | K+、NH4+、Cl-、OH- | D. | Na+、K+、SO42-、I- |
2.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;还原剂的还原性大于还原产物的还原性.现有以下反应( )
①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,
下列说法正确的是.
①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,
下列说法正确的是.
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
19.下列原子构成的单质中既能与稀硫酸反应又能与烧碱溶液反应,都产生H2的是( )
| A. | 核内无中子的原子 | |
| B. | 价电子构型为3s23p1 | |
| C. | 最外层电子数等于倒数第三层上的电子数的原子 | |
| D. | N层上无电子,最外层上的电子数等于电子层数的原子 |
20.用下列实验装置进行相应实验,能达到实验目的是( )
| 选项 | A | B | C | D |
| 装置 | 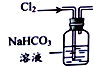 | 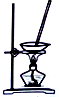 | 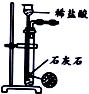 | 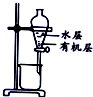 |
| 目的 | 除去Cl2中含有的少量HCl | 蒸发NaCl饱和溶液制备NaCl晶体 | 制取少量纯净的CO2气体 | 分离酒精和水的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |
 C.CH3CH═CHCH2OH D.
C.CH3CH═CHCH2OH D.