题目内容
(18分)(一)按要求作答:
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为: 。
(2)3d能级为半充满的正三价离子,该离子的电子排布式为 。
(二)A、B、C、D、E五种元素为1~18号元素。已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30。它们两两形成的化合物有甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:
(1)E-的结构示意图是________________。B原子核外有________个未成对电子,它们的能量______________(填“相等”或“不相等”)。
(2)向甲的水溶液中加入MnO2可用于实验室制备C的单质,其化学方程式是____________________。
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为___________。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是____________________。
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为: 。
(2)3d能级为半充满的正三价离子,该离子的电子排布式为 。
(二)A、B、C、D、E五种元素为1~18号元素。已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30。它们两两形成的化合物有甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:
| | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A和C 1∶1 | B和A 1∶2 | D和E 1∶3 | B和E 1∶4 |
(2)向甲的水溶液中加入MnO2可用于实验室制备C的单质,其化学方程式是____________________。
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为___________。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是____________________。
(一)(6分,每空3分)
(1)3d54s1(2)1s22s22p63s23p63d5
(二) (12分,每空2分)
(1) 2 相等
(2)2H2O2 = 2H2O+O2↑
(3)CH2=CH2
(4)Al3++3HCO-3====Al(OH)3↓+3CO2↑
(1)3d54s1(2)1s22s22p63s23p63d5
(二) (12分,每空2分)
(1) 2 相等
(2)2H2O2 = 2H2O+O2↑
(3)CH2=CH2
(4)Al3++3HCO-3====Al(OH)3↓+3CO2↑
试题分析:
(一)第四周期中,未成对电子数最多的原子是Cr,其外围电子排布式为3d5 4s1,3d能级为半充满的正三价离子,该离子是Fe,该离子的电子排布式为1s22s22p63s23p63d5
(二)(1)根据B原子最外层电子数比其次外层电子数多2;可推出其为碳,A为氢,C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30,可以推出C为氧D为铝E为氯,由此可以推出甲为过氧化氢,乙为乙烯,丙为氯化铝,丁为四氯化碳。
(2)过氧化氢加入二氧化锰制氧气反应式为:2H2O2 = 2H2O+O2↑
(3)乙烯的结构简式为CH2=CH2
(4)氯化铝与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式Al3++3HCO-3====Al(OH)3↓+3CO2↑
点评:本题考察的知识点多,正确的推出各元素是解题的关键,可以根据题目信息和问题来进行推断。

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
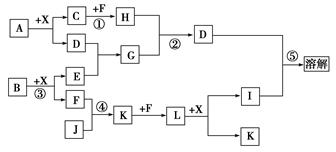
 质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素。
质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素。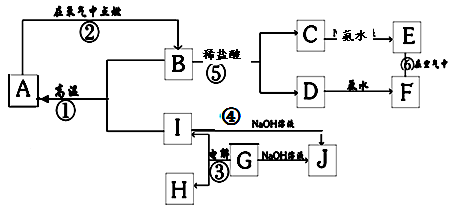
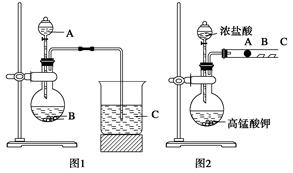
 He,每百吨
He,每百吨 He的形式存在。下列说法正确的是
He的形式存在。下列说法正确的是
 红色石蕊试纸变蓝;X、F和Y为气体单质,且Y为有色气体,F为空气的主要成分之一;G为正盐,G和无色气体M在溶液中可反应生成B。
红色石蕊试纸变蓝;X、F和Y为气体单质,且Y为有色气体,F为空气的主要成分之一;G为正盐,G和无色气体M在溶液中可反应生成B。
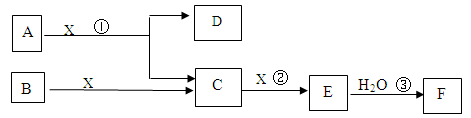
 4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是  提高C的转化率
提高C的转化率
 (填序号)
(填序号) 属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。