题目内容
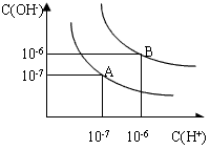
4.强碱性溶液中能大量共存的离子组是( )| A. | Na+、Fe2+、Cl-、SO42- | B. | K+、Ag+、Cl-、NO3- | ||
| C. | Ba2+、Na+、NO3-、CO32- | D. | Na+、K+、CO32-、SO32- |
分析 强碱溶液中含大量的OH-,根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.碱性溶液中不能大量存在Fe2+,故A不选;
B.Ag+、Cl-结合生成沉淀,不能大量共存,故B不选;
C.Ba2+、CO32-结合生成沉淀,不能大量共存,故C不选;
D.碱性溶液中该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 标准状况下,22.4L庚烷所含有的分子数为NA | |
| B. | 1mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,CH4和C2H4的混合气体22.4L,所含的分子数为约为NA | |
| D. | 26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
15.在给定的四种溶液中,各离子能在该溶液中大量共存的是( )
| A. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN- | |
| B. | pH为1的溶液:Fe2+、K+、ClO-、Cl- | |
| C. | c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、NO3- | |
| D. | 存在较多的H+、SO42-、NO3-的溶液:Al3+、CH3COO-、Cl- |
12.有两种金属组成的混合物粉末13g与足量的稀盐酸反应,生成11.2L(标准状况下)H2,则该混合物的组成不可能是( )
| A. | Fe、Zn | B. | Al、Cu | C. | Al、Fe | D. | Cu、Mg |
19.下列属于化学变化的且生成物总能量比反应物总能量高的是( )
①液态水汽化;②N2与氧气反应生成NO;③NH4Cl与Ba(OH)2.8H2O反应;④氯酸钾分解制氧气;⑤H2与氧气反应生成H2O.
①液态水汽化;②N2与氧气反应生成NO;③NH4Cl与Ba(OH)2.8H2O反应;④氯酸钾分解制氧气;⑤H2与氧气反应生成H2O.
| A. | ①③④ | B. | ②③④ | C. | ②③ | D. | ③④ |
13.检验机动车驾驶员是否“酒后驾驶”是利用橘黄色经硫酸酸化的CrO3溶液吸收乙醇,依据生成的绿色Cr3+的浓度来确定,其反应原理为CrO3+CH3CH2OH+H2SO4→Cr2(SO4)3+CH3CHO+H2O(未配平).下列说法正确的是( )
| A. | 该反应中CH3CH2OH表现氧化性 | |
| B. | 该反应发生氧化反应的过程是CrO3→Cr2(SO4)3 | |
| C. | 该反应中氧化产物与还原产物的物质的量之比为2:3 | |
| D. | 该反应中每生成1mol H2O转移1mol电子 |
14.下列有关胶体的叙述中不正确的是( )
| A. | 淀粉溶胶中胶体微粒直径大小在1~100nm | |
| B. | 用一束光照射氢氧化铁胶体,可以观察到一条光亮的通路 | |
| C. | 向烧杯中沸腾的蒸馏水里加几滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热可得氢氧化铁胶体 | |
| D. | 可以利用过滤操作来分离胶体粒子和溶液 |

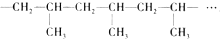 其重复结构单元即它的链节是
其重复结构单元即它的链节是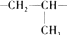 .
.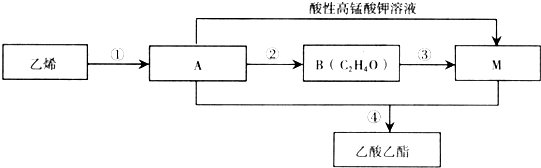
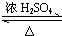 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.