题目内容
【题目】硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1所示。
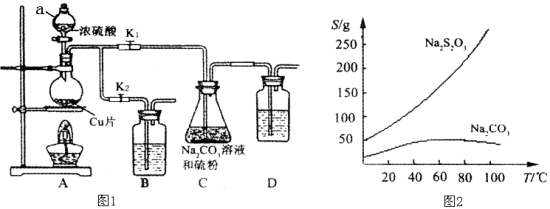
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的 (填编号)。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18. 00 mL。部分反应的离子方程式为:Cr2O72- + 6 I- + 14H+ = 2 Cr3+ + 3 I2 + 7 H2O;I2 + 2 S2O32- = S4O62-+2I-。则该废水中Ba2+的物质的量浓度为 。
【答案】(1)关闭K2打开K1,在D中加水淹没导管末端,双手捂住烧瓶(2分)
ACD(2分) 冷却结晶(2分)
(2)Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl(2分)
(3)0.0024mol·L-1(2分)
【解析】
试题分析:(1)根据装置图的特点,检查A、C装置气密性的操作是关闭K2打开K1,在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶,若导气管末端有气泡冒出,松开热毛巾,在导气管中形成一段水柱,说明气密性良好;装置B、D的作用吸收SO2 ,防止污染空气,所以药品选用与SO2 反应的物质,下列物质中的NaOH、饱和NaHCO3溶液、酸性KMnO4溶液与SO2 反应,而浓硫酸不反应,选ADC;由于Na2S2O3在酸性溶液中不能稳定存在,容易分解,所以把pH控制在7~10之间;根据硫代硫酸钠的溶解度曲线图可知,硫代硫酸钠的溶解度随温度的升高而增大,所以获得产品的操作是将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品;(2)向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,说明S2O32-与Cl2反应生成SO42-,硫元素由+2价升高到+6价,则Cl2需得电子生成Cl-,该反应的化学方程式为Na2S2O3 + 4 Cl2 + 5 H2O = Na2SO4 + H2SO4 + 8 HCl;(3)根据题给信息可得如下关系式:Ba2+ ~ BaCrO4 ~ 0.5 Cr2O72- ~ 1.5 I2 ~ 3 Na2S2O3,则n(Ba2+)=1/3×0.010×18×1000-3 mol= 0.00006 mol,c(Ba2+) = 0.0006/0.025 mol·L-1=0.0024 mol·L-1。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案