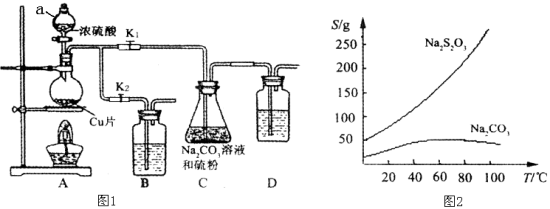
题目内容
【题目】分部分短周期元素化合价与原子序数的关系可用右图表示。

(1)写出Q的元素符号 ,其原子结构示意图是 。
(2)写出X、Z形成的化合物与Y的最高价氧化物对应的水化物反应的离子方程式 ;
(3)写出两种W的含氧酸的化学式 、 ,请设计一种实验方案比较两种酸的酸性强弱 。
【答案】(1)Si;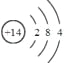 ;(2)Al2O3+2OH-=2AlO2-+H2O
;(2)Al2O3+2OH-=2AlO2-+H2O
(3)H2SO3;H2SO4;①用玻璃棒分别蘸取等浓度的两种酸,滴到pH试纸上,观察试纸红色的深浅,颜色深的是硫酸,颜色浅的是亚硫酸;②分别取等浓度的两种酸溶液,测量导电性的强弱,导电性强的是硫酸,导电性弱的是亚硫酸;③向亚硫酸钠中滴加硫酸,检验是否生成SO2气体,生成说明硫酸酸性强于亚硫酸,不生成说明硫酸酸性弱于亚硫酸。
【解析】试题分析:都是短周期元素,由表中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素;Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素;Z为+3价,原子序数大于Na为Al元素;Q为Si元素;W的化合价为+6、-2价,故W为S元素;R的最高正价为+7价,应为Cl元素。
(1)Q为Si元素;其原子结构示意图为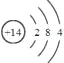 ,故答案为:Si;
,故答案为:Si;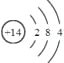 ;
;
(2)氧化铝与氢氧化钠反应生成偏铝酸钠溶液和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)硫的两种含氧酸的化学式分别为H2SO3、H2SO4;可以根据硫酸与亚硫酸钠能够反应生成二氧化硫气体;硫酸的酸性比亚硫酸强;硫酸是强电解质,亚硫酸是弱电解质等设计实验比较两种酸的酸性强弱,方案如下:①用玻璃棒分别蘸取等浓度的两种酸,滴到pH试纸上,观察试纸红色的深浅,颜色深的是硫酸,颜色浅的是亚硫酸;②分别取等浓度的两种酸溶液,测量导电性的强弱,导电性强的是硫酸,导电性弱的是亚硫酸;③向亚硫酸钠中滴加硫酸,检验是否生成SO2气体,生成说明硫酸酸性强于亚硫酸,不生成说明硫酸酸性弱于亚硫酸,故答案为:①用玻璃棒分别蘸取等浓度的两种酸,滴到pH试纸上,观察试纸红色的深浅,颜色深的是硫酸,颜色浅的是亚硫酸;②分别取等浓度的两种酸溶液,测量导电性的强弱,导电性强的是硫酸,导电性弱的是亚硫酸;③向亚硫酸钠中滴加硫酸,检验是否生成SO2气体,生成说明硫酸酸性强于亚硫酸,不生成说明硫酸酸性弱于亚硫酸。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案【题目】(1)下列变化:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。(填序号)
化学键没有被破坏的是________;仅发生离子键破坏的是_______ ; 仅发生共价键破坏的是________;既发生离子键又发生共价键破坏的是_______。
(2)已知1mol Si中含1mol Si—Si键。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/ kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
①已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列物质的熔点高低(填“>”或“<”):SiC________Si。
②工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。
Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。