题目内容
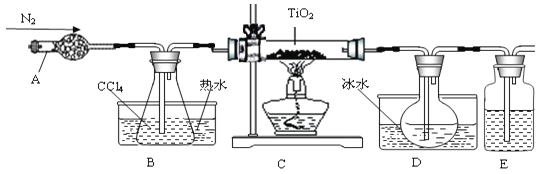
【题目】实验室利用反应TiO2(s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通N2一段时间后点燃酒精灯。
(2)反应结束后的操作包括:a停止通N2;b熄灭酒精灯;c冷却至室温。正确的顺序为 (填序号)。选择这种顺序的理由是 ; 欲分离D中的液态混合物,所采用操作的名称是 。
【答案】(1)干燥管(1分) 浓H2SO4(2分) 检查气密性(2分)
(2)bca(2分) 蒸馏(1分)
【解析】
试题分析:(1)仪器A的名称是球形干燥管,仪器B的作用是加热CCl4,使整个装置充满四氯化碳蒸汽;E的作用是防止空气中的水蒸气进入D装置,防止四氯化钛遇潮湿空气产生白雾,因此该洗气瓶中所盛试剂为液态干燥剂,因此常用浓硫酸防止TiCl4潮解;任何有气体参加的反应或制备气体的反应,在反应开始前都要检查装置的气密性;(2)反应结束后,正确的操作顺序是b熄灭酒精灯、c却至室温、a停止通氮气;由表中熔沸点数据信息可知,-25 < -23 < 25 < 76 < 136,说明常温常压下TiCl4和CCl4均为液体,二者组成互溶的液态混合物,但两组分的沸点不同且相差较大(超过30℃),由混合物分离提纯的物理方法可知,分离二者的方法是蒸馏。

 黄冈天天练口算题卡系列答案
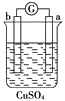
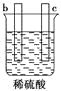
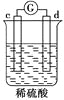
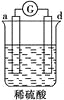
黄冈天天练口算题卡系列答案【题目】有a、b、c、d四个金属电极,有关的化学装置、部分反应现象如下:
实验装置 |
|
|
|
|
实验现象 | a极质量减小, b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. a>b>c>d B. b>c>d>a C. a>b>d>c D. d>a>b>c
【题目】(1)下列变化:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。(填序号)
化学键没有被破坏的是________;仅发生离子键破坏的是_______ ; 仅发生共价键破坏的是________;既发生离子键又发生共价键破坏的是_______。
(2)已知1mol Si中含1mol Si—Si键。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/ kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
①已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列物质的熔点高低(填“>”或“<”):SiC________Si。
②工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。
Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。