题目内容
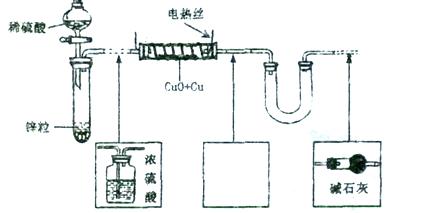
现有氧化铜和铜粉组成的混合物。某同学利用下图所示装置,通过测定混合物质量、实验前后U型管质量变化来确定混合物中氧化铜的质量分数。
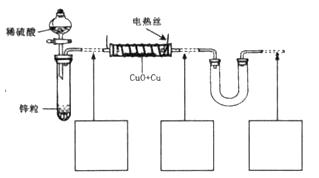
回答下列问题:
(1)U形管中可以加入的物质是_________(填序号);
A.浓 B.无水硫酸铜粉 C.无水氯化钙颗粒
B.无水硫酸铜粉 C.无水氯化钙颗粒
(2)下列步骤按实验操作顺序应为_________(填字母);
A.停止通氢气; B.电热丝通电; C.通人氢气;
D.装置气密性检查; E.电热丝停止通电。
(3)为准确测定数据,你认为本装置是否完整?若需要改进,请在图中虚线下面的方框内画出所需添加的装置示意图并注明必要的物质名称。若无需改进,则将装置图中虚线部分改为实线;
(4)实验结束后,该同学交给老师的实验报告主要项目如图(具体内容已略)。请你根据实验报告的撰写要求,对此份报告作出评价,若已完整,则无需填写,若不完整,请在下面的空格中写出所缺项目______ _______ __;

(5)老师看完实验报告后指出,改变实验原理可以设计出更加简便的实验方案。请用化学方程式表示你设计的新方案的反应原理____ ________,
该方案需测定的数据____________________。

回答下列问题:
(1)U形管中可以加入的物质是_________(填序号);
A.浓
 B.无水硫酸铜粉 C.无水氯化钙颗粒
B.无水硫酸铜粉 C.无水氯化钙颗粒(2)下列步骤按实验操作顺序应为_________(填字母);
A.停止通氢气; B.电热丝通电; C.通人氢气;
D.装置气密性检查; E.电热丝停止通电。
(3)为准确测定数据,你认为本装置是否完整?若需要改进,请在图中虚线下面的方框内画出所需添加的装置示意图并注明必要的物质名称。若无需改进,则将装置图中虚线部分改为实线;
(4)实验结束后,该同学交给老师的实验报告主要项目如图(具体内容已略)。请你根据实验报告的撰写要求,对此份报告作出评价,若已完整,则无需填写,若不完整,请在下面的空格中写出所缺项目______ _______ __;

(5)老师看完实验报告后指出,改变实验原理可以设计出更加简便的实验方案。请用化学方程式表示你设计的新方案的反应原理____ ________,
该方案需测定的数据____________________。
(1)C(2分)
(2)d c b e a(2分)
(3) (5分,其中连接1分,另每空2分)
(5分,其中连接1分,另每空2分)
(4)实验名称、实验步骤(2分,只要答出实验步骤即可给2分)
(5)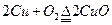 (2分)混合物反应前后的质量 (2分,其他合理答案同样得分
(2分)混合物反应前后的质量 (2分,其他合理答案同样得分
(2)d c b e a(2分)
(3)
 (5分,其中连接1分,另每空2分)
(5分,其中连接1分,另每空2分)(4)实验名称、实验步骤(2分,只要答出实验步骤即可给2分)
(5)
 (2分)混合物反应前后的质量 (2分,其他合理答案同样得分
(2分)混合物反应前后的质量 (2分,其他合理答案同样得分略

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目


 。
。

 C
C 。
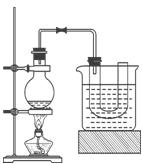
。
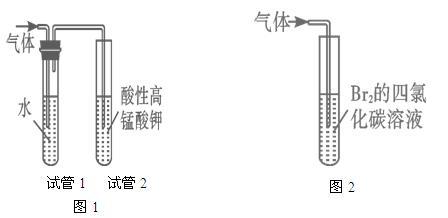
 CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究:
CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究: