题目内容
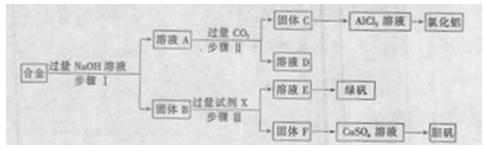
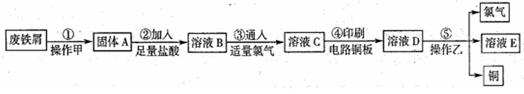
为探索工业废料的再利用,某化学兴趣小组设计了如图-5实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)步骤I、II、III中均需进行的实验操作是 。
(2)溶液A中的离子主要有 ;试剂X是 。
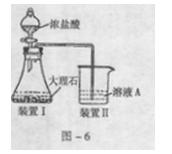
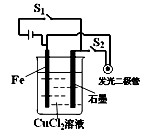
(3)进行步骤II时,该小组用图-6所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是 (用离子方程式表示);为了避免固体C减少,根据图-6所示,改进的措施是 。
(4)从环境保护角度考虑,用固体F制备CuSO4溶液的化学方程式是 。

请回答:
(1)步骤I、II、III中均需进行的实验操作是 。
(2)溶液A中的离子主要有 ;试剂X是 。
(3)进行步骤II时,该小组用图-6所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是 (用离子方程式表示);为了避免固体C减少,根据图-6所示,改进的措施是 。

(4)从环境保护角度考虑,用固体F制备CuSO4溶液的化学方程式是 。

略

练习册系列答案
相关题目
 -二氯乙烷已发生消去反应的现象是_______________,还可通过什
-二氯乙烷已发生消去反应的现象是_______________,还可通过什 么实验加以验证:________________________________________。
么实验加以验证:________________________________________。 Cu(OH)2均不带结晶水;
Cu(OH)2均不带结晶水;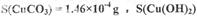
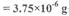 ;若由此数据判断,假设_______是不正确的。
;若由此数据判断,假设_______是不正确的。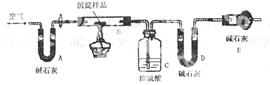

 B.无水硫酸铜粉 C.无水氯化钙颗粒
B.无水硫酸铜粉 C.无水氯化钙颗粒
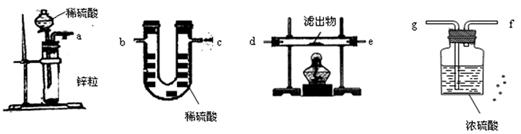
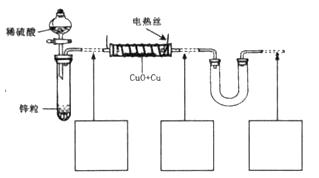
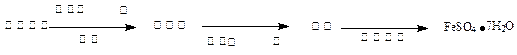 (3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
(3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是