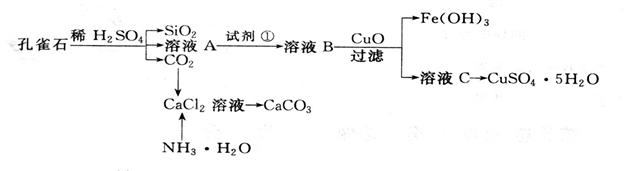
题目内容
某实验探究小组根据乙醛还原新制Cu(OH)2的实验操作和实验现象。对反应方程式“CH3CHO+2Cu(OH)2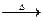 CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究:
CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究:
(一)查阅资料
(1)质量分数为10%的NaOH溶液密度为1.1g·cm-3,该溶液的c(NaOH)= mol/L;质量分数为2%的CuSO4溶液密度为1.0g·cm—3,其c(CuSO4)=0.125mol/L。
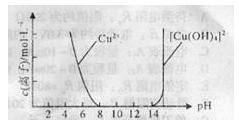
(2)Cu(OH)2可溶于浓的强碱溶液生成深蓝色
的[Cu(OH)4]2-溶液,CuSO4溶液与NaOH
溶液反应过程中Cu2+与[Cu(OH)4]2—浓度
变化如右图所示:
(3)Cu2O、CuO均可溶于CH3COOH;在溶液中
可发生2Cu+==Cu+Cu2+反应。
(二)实验操作及实验现象
(1)在2mL 10%的NaOH溶液中滴加4~6滴(约0.2mL)2%CuSO4溶液,经测定混合溶液中c(OH-)约为2.5mol/L。
(2)若对上述混合物进行过滤,可得到浅蓝色的 (填化学式)固体,滤液呈深蓝色,则显深蓝色的离子是 (填离子符号)。
(3)在第(1)步所得的混合物中加入0.5mL 乙醛,加热至沸腾,产生砖红色沉淀。
(三)对“CH3CHO+2Cu(OH)2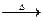 CH3COOH+Cu2O↓+2H2O”质疑的理由:
CH3COOH+Cu2O↓+2H2O”质疑的理由:
(1) ;(2) 。
(四)结论:根据上述探究,乙醛与新制Cu(OH)2反应的离子方程式为
。
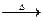 CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究:
CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究:
(一)查阅资料
(1)质量分数为10%的NaOH溶液密度为1.1g·cm-3,该溶液的c(NaOH)= mol/L;质量分数为2%的CuSO4溶液密度为1.0g·cm—3,其c(CuSO4)=0.125mol/L。
(2)Cu(OH)2可溶于浓的强碱溶液生成深蓝色
的[Cu(OH)4]2-溶液,CuSO4溶液与NaOH
溶液反应过程中Cu2+与[Cu(OH)4]2—浓度
变化如右图所示:
(3)Cu2O、CuO均可溶于CH3COOH;在溶液中
可发生2Cu+==Cu+Cu2+反应。
(二)实验操作及实验现象
(1)在2mL 10%的NaOH溶液中滴加4~6滴(约0.2mL)2%CuSO4溶液,经测定混合溶液中c(OH-)约为2.5mol/L。
(2)若对上述混合物进行过滤,可得到浅蓝色的 (填化学式)固体,滤液呈深蓝色,则显深蓝色的离子是 (填离子符号)。
(3)在第(1)步所得的混合物中加入0.5mL 乙醛,加热至沸腾,产生砖红色沉淀。
(三)对“CH3CHO+2Cu(OH)2
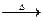 CH3COOH+Cu2O↓+2H2O”质疑的理由:
CH3COOH+Cu2O↓+2H2O”质疑的理由:(1) ;(2) 。
(四)结论:根据上述探究,乙醛与新制Cu(OH)2反应的离子方程式为
。

略

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目

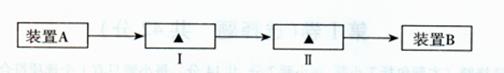
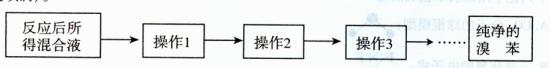
 。操作2目的: 。
。操作2目的: 。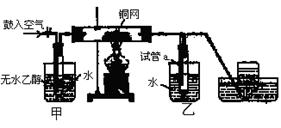
 B.无水硫酸铜粉 C.无水氯化钙颗粒
B.无水硫酸铜粉 C.无水氯化钙颗粒
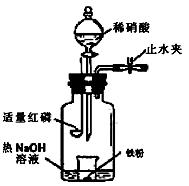
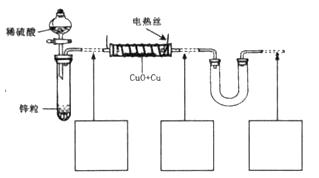
 微粒符号表示 );
微粒符号表示 ); _______________________________________________________________________
_______________________________________________________________________