题目内容
某研究性学习小组进行溴乙烷的制备及性质探究实验。
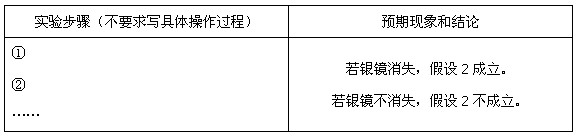
探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
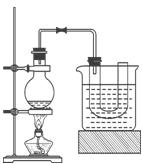
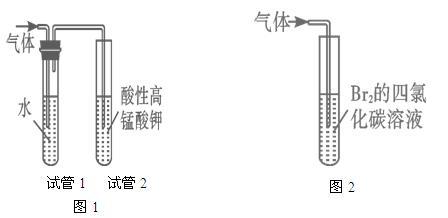
探究二:学习小组在进行溴乙烷与NaOH乙醇溶液的反应实验中,观察到有气体生成。他们设计了两种不同的方法分别检验该气体,实验装置如图
请回答:
(5)图1中,试管1的作用是:________________________________;
图2中发生的反应是:________________________________(用化学方程式表示)。

探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
| A.氢氧化钠稀溶液 | B.碳酸钠稀溶液 |
| C.硝酸银溶液 | D.四氯化碳 |

请回答:
(5)图1中,试管1的作用是:________________________________;
图2中发生的反应是:________________________________(用化学方程式表示)。
(1)防止乙醇挥发
(2)2HBr+H2SO4(浓) Br2+SO2↑+2H2O
Br2+SO2↑+2H2O
[或2NaBr+3H2SO4(浓) Br2+SO2↑+2NaHSO4+2H2O];
Br2+SO2↑+2NaHSO4+2H2O];
Br2+H2O=HBrO+HBr
(3)水浴加热
(4)上层; B
(5)除去乙醇蒸气;CH2=CH2 + Br2 CH2BrCH2Br
CH2BrCH2Br
(2)2HBr+H2SO4(浓)
 Br2+SO2↑+2H2O
Br2+SO2↑+2H2O[或2NaBr+3H2SO4(浓)
 Br2+SO2↑+2NaHSO4+2H2O];
Br2+SO2↑+2NaHSO4+2H2O];Br2+H2O=HBrO+HBr
(3)水浴加热
(4)上层; B
(5)除去乙醇蒸气;CH2=CH2 + Br2
 CH2BrCH2Br
CH2BrCH2Br略

练习册系列答案
相关题目
 B.无水硫酸铜粉 C.无水氯化钙颗粒
B.无水硫酸铜粉 C.无水氯化钙颗粒


 (3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
(3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是  究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成_______个实验进行对比即可得出结论。
究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成_______个实验进行对比即可得出结论。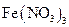 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究: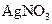 溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止 具有氧化性,能氧化Ag。
具有氧化性,能氧化Ag。 能氧化Ag。
能氧化Ag。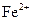 ,验证了假设1的成立。请写出
,验证了假设1的成立。请写出