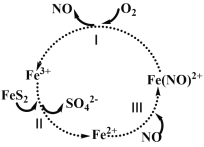
题目内容
【题目】(1)A、B、C为同一短周期金属元素。依据下表数据分析,A、B、C三种元素的离子半径由大到小的顺序是_____。(用离子符号表示)
电离能/kJmol-1 | I1 | I2 | I3 | I4 |
A | 500 | 4600 | 6900 | 9500 |
B | 740 | 1500 | 7700 | 10500 |
C | 580 | 1800 | 2700 | 11600 |
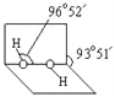
(2)已知H2O2分子的空间结构如图所示,H2O2分子中氧原子采取____________杂化;H2O2分子是______(填“极性分子”或“非极性分子”)。
(3)R是第4周期元素中未成对电子数最多的原子。R3+在溶液中存在如下转化:
R3+![]() R(OH)3
R(OH)3![]() [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为_____。
②[R(OH)4]-中存在的化学键是_____;1mol[R(OH)4]-离子中含有σ键的数目为_______mol。
A.离子键 B.极性键 C.非极性键D .配位键
【答案】Na>Mg>Al sp3 极性分子 3d54s1 BD 8
【解析】
(1)由表中数据可知,C的第四电离能剧增,故C表现+3价,为金属Al元素,由表中数据可知,A第二电离能剧增,故A表现+1价,为Na元素,B的第三电离能剧增,表现+2价,为Mg元素,同周期自左而右原子半径减小,故原子半径:Na>Mg>Al,故答案为:Na>Mg>Al;
(2)由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,杂化方式为sp3,H2O2分子的正负电荷中心不重叠,是极性分子;
故答案为:sp3;极性分子;
(3)①R是1~36号元素中未成对电子数最多的原子,则R原子外围电子排布为3d54s1,故答案为:3d54s1;
②R为Cr元素,[Cr(OH)4]-与[Al(OH)4]-结构相似,Cr3+与OH-之间形成配位键,氧原子与氢原子之间形成极性键,故选BD;又因为该离子中化学键均为σ键,1mol[R(OH)4]-离子中含有σ键的数目为4mol+4mol=8mol。
故答案为:BD;8。

 小题狂做系列答案
小题狂做系列答案【题目】在容积一定的密闭容器中发生可逆反应A(g)+B(g)![]() C(g)H>0,平衡移动关系如图所示。下列说法正确的是( )
C(g)H>0,平衡移动关系如图所示。下列说法正确的是( )
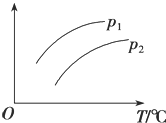
选项 | 压强 | 纵坐标 |
A | p1<p2 | C的物质的量浓度 |
B | p1>p2 | B的转化率 |
C | p1<p2 | 混合气体的平均摩尔质量 |
D | p1>p2 | A的质量分数 |
A.AB.BC.CD.D