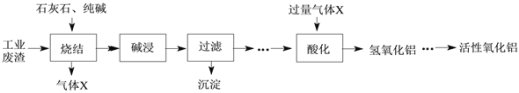
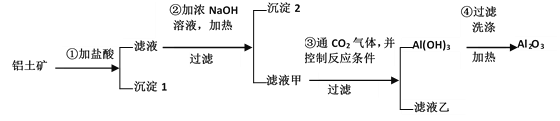
题目内容
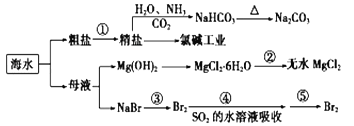
【题目】“盐泥”是氯碱工业中产生的。盐泥中含 NaCl(15%~20%)、Mg(OH)2(15%~20%)、
CaCO3(15%~20%)和BaSO4 等不溶于酸的物质。用“盐泥”生产七水硫酸镁,设计了如下工艺流程:
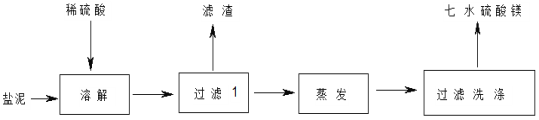
(1)电解食盐水前,为除去粗食盐水中的 Mg2+、Ca2+、SO42-等杂质离子,下列试剂加入的先后顺序合理的是_____(填序号)。
A.碳酸钠溶液 B.氢氧化钠溶液 C.氯化钡溶液 D.盐酸
(2)已知Ksp[Mg(OH)2]=6.0×10-12。设食盐水中 Mg2+的浓度为 0.06 mol·L-1,则加入氢氧化钠溶液后使溶液的 pH≥_____才可能产生 Mg(OH)2 沉淀。
(3)氯碱工业上电解食盐水阴极发生的反应是_____。
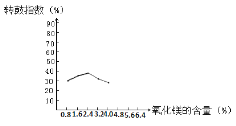
(4)三种化合物的溶解度(S)随温度变化曲线见下图

在“过滤Ⅰ” 中需要趁热过滤,其主要原因是_________;滤渣的主要成分有不溶于酸的物质、_________。
(5)检验 MgSO4·7H2O 中杂质是否洗涤干净的操作是_____。
【答案】BACD或ABCD或ACBD 9 2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-) 温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4·2H2O溶解度小) 硫酸钡(BaSO4)、硫酸钙(CaSO4或CaSO4·2H2O) 取最后洗涤液少许于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液滴加硝酸酸化的AgNO3溶液,无沉淀产生。
【解析】
(1)加入的钡离子可以由碳酸钠除去,故最后加碳酸钠,钡试剂与氢氧化钠先后都可,故加入试剂的顺序为先加NaOH,后加钡试剂,再加Na2CO3或先加钡试剂,后加NaOH,再加Na2CO3,BACD或ABCD或ACBD;
故答案为:BACD或ABCD或ACBD;
(2)已知Ksp[Mg(OH)2]=6.0×10-12。设食盐水中 Mg2+的浓度为 0.06 mol·L-1,c(OH-)=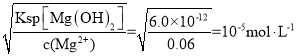 ,氢离子浓度为10-9mol·L-1,则加入氢氧化钠溶液后使溶液的 pH≥9才可能产生 Mg(OH)2 沉淀。故答案为:9;
,氢离子浓度为10-9mol·L-1,则加入氢氧化钠溶液后使溶液的 pH≥9才可能产生 Mg(OH)2 沉淀。故答案为:9;
(3)H+比Na+容易得到电子,因而H+不断地从阴极获得电子被还原为氢原子,并结合成氢分子从阴极放出,氯碱工业上电解食盐水阴极发生的反应是2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-)。故答案为:2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);
(4)在蒸发浓缩的过程中,温度大于40℃时随温度升高CaSO4·2H2O晶体溶解度降低,故会析出CaSO4·2H2O晶体,且应该趁热过滤,防止温度降低CaSO4·2H2O的溶解度变大,又重新溶解,不利于钙盐和镁盐的分离;同时温度降低硫酸镁晶体会析出,造成产量损失;滤渣的主要成分有不溶于酸的物质、盐泥中含有的硫酸钡,蒸发酒精出来的硫酸钙,
故答案为:温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4·2H2O溶解度小);硫酸钡(BaSO4)、硫酸钙(CaSO4或CaSO4·2H2O);
(5)滤液中的硫酸根离子会影响氯离子的干扰,应该先除去硫酸根离子,再检验氯离子,方法为:取最后洗涤液少许于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液滴加硝酸酸化的AgNO3溶液,无沉淀产生。
故答案为:取最后洗涤液少许于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液滴加硝酸酸化的AgNO3溶液,无沉淀产生。

【题目】在容积一定的密闭容器中发生可逆反应A(g)+B(g)![]() C(g)H>0,平衡移动关系如图所示。下列说法正确的是( )
C(g)H>0,平衡移动关系如图所示。下列说法正确的是( )
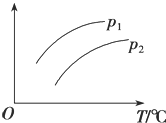
选项 | 压强 | 纵坐标 |
A | p1<p2 | C的物质的量浓度 |
B | p1>p2 | B的转化率 |
C | p1<p2 | 混合气体的平均摩尔质量 |
D | p1>p2 | A的质量分数 |
A.AB.BC.CD.D