题目内容
【题目】二元化合物X可由单质硫和Ca(OH)2浊液共热制得。取一定量X与100 mL 0.2 mol·L1稀硫酸恰好完全反应,生成0.08 mol淡黄色沉淀和0.448 L气体甲(已折算为标准状况)。请回答:
(1) 甲的电子式为________。
(2) X的化学式为________。
(3) X与稀硫酸反应的化学方程式为________。
(4) 单质硫和Ca(OH)2浊液制X时,还生成另一种含氧酸盐(M<160 g·mol 1),该盐与稀硫酸反应也有淡黄色沉淀生成并放出刺激性气味气体,则单质硫与Ca(OH)2浊液反应制X的化学方程式为________。
(5) 气体甲通入硫酸铁溶液中能发生反应。请设计实验方案验证反应后溶液中除H+之外的阳离子________。
【答案】![]() CaS5或S5Ca CaS5+H2SO4=CaSO4+4S↓+H2S↑ 12S+3Ca(OH)2=2CaS5+CaS2O3+3H2O 取反应后溶液分成两份,一份滴加KSCN溶液,若溶液显血红色,则说明有Fe3+;另一份(加热使过量的H2S逸出)滴加酸性KMnO4溶液,若紫色褪去或变浅,则说明有Fe2+
CaS5或S5Ca CaS5+H2SO4=CaSO4+4S↓+H2S↑ 12S+3Ca(OH)2=2CaS5+CaS2O3+3H2O 取反应后溶液分成两份,一份滴加KSCN溶液,若溶液显血红色,则说明有Fe3+;另一份(加热使过量的H2S逸出)滴加酸性KMnO4溶液,若紫色褪去或变浅,则说明有Fe2+
【解析】
二元化合物X可由单质硫和Ca(OH)2浊液共热制得,应含有钙元素和硫元素,取一定量X与100 mL 0.2 mol·L1稀硫酸恰好完全反应,生成0.08 mol淡黄色沉淀为硫,和0.448 L气体甲为硫化氢,假设X中硫元素的化合价为-x价,反应中生成硫单质,化合价升高x价,生成硫化氢,硫的化合价降低2-x,根据硫和硫化氢的物质的量比分析,有4x=2-x,解x=0.4,则X的化学式为CaS5或S5Ca。
(1).硫化氢的电子式为: ![]() ;
;
(2)根据以上分析可知X为 CaS5或S5Ca;
(3)根据题意CaS5和硫酸反应生成硫酸钙和硫和硫化氢,方程式为: CaS5+H2SO4=CaSO4+4S↓+H2S↑ ;
(4) 另一种含氧酸盐(M<160 g·mol 1),该盐与稀硫酸反应也有淡黄色沉淀生成并放出刺激性气味气体二氧化硫,说明该物质为CaS2O3,则硫和氢氧化钙的方程式为:12S+3Ca(OH)2=2CaS5+CaS2O3+3H2O;
(5)硫化氢和硫酸铁反应生成硫和硫酸亚铁和硫酸,溶液中的阳离子除了氢离子外,还有亚铁离子,可能有铁离子,所以利用铁离子遇到硫氰化钾显红色检验,利用亚铁离子能使高锰酸钾溶液褪色碱性,实验方法为:取反应后溶液分成两份,一份滴加KSCN溶液,若溶液显血红色,则说明有Fe3+;另一份(加热使过量的H2S逸出)滴加酸性KMnO4溶液,若紫色褪去或变浅,则说明有Fe2+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某学习小组在容积固定为2 L的密闭容器内充入1 mol N2和3 mol H2合成NH3。恒温下开始反应,并用压力传感器测定压强如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
下列说法不正确的是
A.不断地将NH3液化并移走,有利于反应正向进行
B.其它条件不变,在30 min时,若压缩容器的体积,N2的平衡转化率增大
C.从反应开始到10 min时,v(NH3)=0.035 mol·L1·min1
D.在30 min时,再加入0.5 mol N2、1.5 mol H2和2 mol NH3,平衡向逆反应方向移动
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
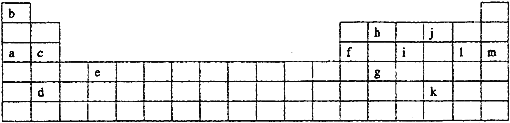
如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力 B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7296 | 4570 | 1820 |
失去第三个电子 | 11799 | 6920 | 2750 |
失去第四个电子 | 9550 | 11600 |
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______________________________;
(2)表中X可能为以上13种元素中的______(填写字母)元素。用元素符号表示X和j形成化合物的化学式________;
(3)Y是周期表中_______族元素;
(4)以上13种元素中,_____(填写字母)元素原子失去核外第一个电子需要的能量最多。