题目内容
【题目】下列实验不能达到实验目的的是( )
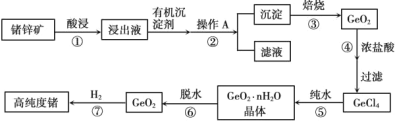
A. 实验室制取氨气
实验室制取氨气
B.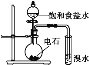 证明乙炔可使溴水褪色
证明乙炔可使溴水褪色
C.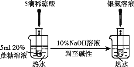 检验蔗糖的水解产物具有还原性
检验蔗糖的水解产物具有还原性
D.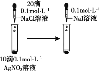 证明溶解度:AgCl>AgI
证明溶解度:AgCl>AgI
【答案】B
【解析】
A. 该图为实验室制用氯化铵和氢氧化钙取氨气的实验装置图,故A正确;
B. 得到的乙炔中含有硫化氢等气体,硫化氢等气体也能使溴水褪色,应该先将得到的气体通入硫酸铜溶液除去杂质,然后将得到的气体通入溴水检验乙炔,故B错误;
C. 检验蔗糖水解产物葡萄糖具有还原性:蔗糖在酸性条件下水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液并水浴加热,在加入银氨溶液之前必须加入NaOH溶液中和未反应的稀硫酸,否则稀硫酸和银氨溶液反应而得不到Ag,故C正确;
D. 向AgNO3溶液中滴加少量NaCl溶液,然后再向其中滴加KI溶液,先生成白色沉淀,后生成黄色沉淀,说明AgI更难溶,溶度积越小其溶解度越小,则溶解度:AgCl>AgI,故D正确;
答案选B。

练习册系列答案
相关题目