题目内容
【题目】如表为元素周期表中的一部分,表中列出10种元素在周期表中的位置,按要求回答下列各题![]() 请用对应的元素符号作答,填序号无效
请用对应的元素符号作答,填序号无效![]()
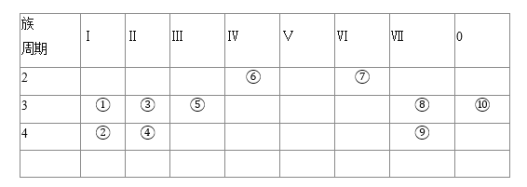
(1)化学性质最不活泼的元素符号是______,金属性最强的单质与水反应的化学方程式是______.
(2)①③⑤三种元素最高价氧化物的水化物中碱性最强的物质的化学式是______.
(3)元素①形成的稳定的氧化物在呼吸面具中供氧时的化学方程式是______,该化合物的焰色反应为______色.
(4)②③⑤三种元素形成的离子,离子半径由大到小的顺序是______.
(5)元素⑧的单质和石灰乳作用可制成有漂白和消毒作用的漂白粉,用化学方程式表示漂白粉在潮湿空气中起漂白作用的原理______.
(6)如何证明⑧和⑨元素的非金属性强弱______.
【答案】Ar ![]() NaOH
NaOH ![]() 、
、![]() 黄 ②>③>⑤
黄 ②>③>⑤ ![]() 将氯气通入NaBr溶液中,如果溶液由无色变为橙色,就说明氯气的氧化性大于溴,则非金属性
将氯气通入NaBr溶液中,如果溶液由无色变为橙色,就说明氯气的氧化性大于溴,则非金属性![]()
【解析】
根据元素在周期表中的位置知,![]() 分别是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar元素,
分别是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar元素,
(1)稀有气体化学性质最不活泼;金属性最强的金属位于周期表左下角;
(2)同一周期,金属元素的金属性随着原子序数增大而减弱,元素的金属性越强,其最高价氧化物的水化物碱性越强;
(3)作为呼吸面具中供氧剂的物质是![]() ,
,![]() 和
和![]() 、
、![]() 反应生成
反应生成![]() ;Na元素的焰色反应呈黄色;
;Na元素的焰色反应呈黄色;
(4)电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(5)元素⑧的单质是氯气,氯气和石灰乳反应是生成![]() 、
、![]() 而制取漂白粉,次氯酸钙不稳定,易和空气中
而制取漂白粉,次氯酸钙不稳定,易和空气中![]() 、
、![]() 反应生成HClO;
反应生成HClO;
(6)元素的非金属性越强,其单质的氧化性越强,根据单质之间的置换反应确定Cl、Br元素的非金属性强弱。
根据元素在周期表中的位置知,![]() 分别是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar元素,
分别是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar元素,
(1)稀有气体化学性质最不活泼,这几种元素中最不活泼的是Ar;金属性最强的金属位于周期表左下角,为K元素,K和水反应方程式为![]() ,
,
故答案为:Ar;![]() ;
;
(2)同一周期,金属元素的金属性随着原子序数增大而减弱,元素的金属性越强,其最高价氧化物的水化物碱性越强,所以这三种元素金属性最强的是Na,其最高价氧化物的水化物为NaOH,
故答案为:NaOH;
(3)作为呼吸面具中供氧剂的物质是![]() ,
,![]() 和
和![]() 、
、![]() 反应生成
反应生成![]() ,反应方程式为
,反应方程式为![]() 、
、![]() ,Na元素的焰色反应呈黄色,
,Na元素的焰色反应呈黄色,
故答案为:![]() 、
、![]() ;黄;
;黄;
(4)电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以这三种元素简单离子半径大小顺序是![]() ,
,
故答案为:②>③>⑤;
(5)元素⑧的单质是氯气,氯气和石灰乳反应是生成![]() 、
、![]() 而制取漂白粉,次氯酸钙不稳定,易和空气中
而制取漂白粉,次氯酸钙不稳定,易和空气中![]() 、
、![]() 反应生成HClO,起漂白作用的是HClO,反应方程式为:
反应生成HClO,起漂白作用的是HClO,反应方程式为:![]() ,
,
故答案为:![]() ;
;
(6)元素的非金属性越强,其单质的氧化性越强,根据单质之间的置换反应确定Cl、Br元素的非金属性强弱,其检验方法为:将氯气通入NaBr溶液中,如果溶液由无色变为橙色,就说明氯气的氧化性大于溴,则非金属性![]() ,
,
故答案为:将氯气通入NaBr溶液中,如果溶液由无色变为橙色,就说明氯气的氧化性大于溴,则非金属性![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验事实得出的相应结论不正确的是
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
C | 2NO2(g) | 加压平衡向着气体颜色加深的方向移动 |
D | 将MgCl2溶液蒸干后灼烧,得到MgO固体 | 蒸干的过程中水解生成的HCl挥发,水解进一步促进生成Mg(OH)2,灼烧后产生MgO |
A. A B. B C. C D. D