��Ŀ����
����Ŀ��ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������X��Z��W����Ԫ�ؿ���ɹ��ۻ�����XH3��H2Z��HW��Y����Ԫ�ؿ��γ����ӻ�����Y2O��Y2O2��
��1��Y2Z�ĵ���ʽ�� ________
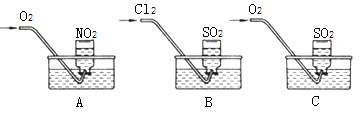
��2��ʵ���ҿ�����ͼ��ʾװ���Ʊ����ռ�XH3(ȱ���ռ�װ�ã��г̶ֹ�װ����ȥ)��
��ͼ�з�����Ӧѡ������_____��ƿ�ռ�XH3���A��B������
��ʵ�����Ʒ��д��Թ��е��Լ�һ��ѡ��(��д��ѧʽ)_________________���ձ�����Һ����ɫ��Ϊ��ɫ����ԭ����(�õ��뷽��ʽ��ʾ)��___________________________________
��XH3�ǹ�ҵ�����������������Ҫ����ԭ�ϣ��Ʊ������и����ʷ����Ļ�ѧ��Ӧ����ʽΪ__________________________��
��3������W2��ȼ�տ��������ֲ������һ�ֲ���ף������и�ԭ������㲻ȫ��8���ӽṹ���Ļ�ѧʽ��_________�� XH3��HW���ֻ������ܷ�Ӧ�������ӻ������ң�n mol����n mol����һ�������·�Ӧ������4n mol HW����һ������û������������ܶ�����ͬ״���������ܶȵ�174�����仯ѧʽ��_________��
���𰸡� ![]() A NH4Cl��Ca(OH)2 NH3H2O
A NH4Cl��Ca(OH)2 NH3H2O![]() NH4++OH 4NH3��5O2
NH4++OH 4NH3��5O2 ![]() 4NO��6H2O PCl5 P3N3Cl6
4NO��6H2O PCl5 P3N3Cl6
�����������������ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W��Y����Ԫ�ؿ��γ����ӻ�����Y2O��Y2O2����YΪNa������X��Z��W����Ԫ�ؿ���ɹ��ۻ�����XH3��H2Z��HW����XΪN��ZΪS��WΪCl��
��1��Na2S�ĵ���ʽ��![]() ��
��
��2�����ռ�NH3�������ſ���������ͼ�з�����Ӧѡ������A��ƿ�ռ�NH3��
��ʵ�����Ʒ��д��Թ��е��Լ�һ��ѡ��NH4Cl��Ca(OH)2���ձ�����Һ����ɫ��Ϊ��ɫ����ԭ���ǰ�����ˮ��Ӧ���ɵ�һˮ�ϰ����������뷽��ʽΪNH3H2O![]() NH4++OH��
NH4++OH��
��NH3�ǹ�ҵ�����������������Ҫ����ԭ�ϣ��Ʊ��������������ʷ�������������ѧ��Ӧ����ʽΪ4NH3��5O2 ![]() 4NO��6H2O��
4NO��6H2O��
��3������Cl2��ȼ�տ��������ֲ������һ�ֲ���ף������и�ԭ������㲻ȫ��8���ӽṹ�����Ϊ���Ȼ��ף��仯ѧʽ��PCl5�� NH3��HCl���ֻ������ܷ�Ӧ�������ӻ������Ȼ����n mol PCl5��n molNH4Cl��һ�������·�Ӧ������4n mol HCl����һ������û������������ܶ�����ͬ״���������ܶȵ�174������û��������Է�������Ϊ348���������غ㶨�ɿ�֪���仯ѧʽ��P3N3Cl6��