题目内容
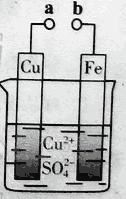
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_______。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=﹣196.6 kJmol-1
2SO3(g) ΔH1=﹣196.6 kJmol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH2=﹣113.0kJmol-1
2NO2(g) ΔH2=﹣113.0kJmol-1
则反应NO2(g)+ SO2(g)![]() SO3(g)+NO(g)的ΔH=________kJmol-1。
SO3(g)+NO(g)的ΔH=________kJmol-1。
一定条件下,将2molNO2与2molSO2置于容积固定的恒温密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________(填字母)
a.混合气体密度保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO3的同时生成1molNO2
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则SO2的转化率将_______(填“增大”“减小”或“不变”)。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=﹣a kJmol-1。在一定温度下,将1molCO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则v(CH3OH)为_______,正反应放出的热量为______。
CH3OH(g) ΔH=﹣a kJmol-1。在一定温度下,将1molCO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则v(CH3OH)为_______,正反应放出的热量为______。
(4)已知N2O4(g)![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是_______。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是_______。
A.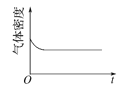 B.
B.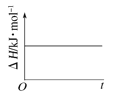 C.
C.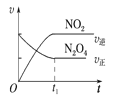 D.
D.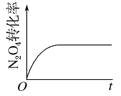
【答案】3NO2+H2O=2HNO3+NO 6.72 -41.8 b 不变 0.006mol/(L·min) 0.3akJ ACD
【解析】
(1)NO2与水反应生成硝酸和NO完成方程式的书写;根据方程式及转移电子数目计算NO2;
(2)根据盖斯定律计算焓变;根据平衡状态的特征判断;根据勒夏特列原理找等效平衡即可;
(3)同一密闭容器中压强之比等于物质的量之比,计算平衡后的总物质的量,再用三段式求解;
(4)根据平衡状态的特征判断。
(1)NO2与水反应生成硝酸和NO,方程式为3NO2+H2O=2HNO3+NO;根据方程式可知,6molNO2参与反应,化合价由+4变为0,得到24mol电子,转移1.2mol电子时,消耗的NO2的物质的量为0.3mol,标况下的体积为6.72L;
(2)已知①2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=﹣196.6 kJmol-1
2SO3(g) ΔH1=﹣196.6 kJmol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH2=﹣113.0kJmol-1
2NO2(g) ΔH2=﹣113.0kJmol-1
根据盖斯定律,(①-②)/2即可得到NO2(g)+ SO2(g)![]() SO3(g)+NO(g),则ΔH=(-196.6+113.0)kJ/mol/2=-41.8kJ/mol;
SO3(g)+NO(g),则ΔH=(-196.6+113.0)kJ/mol/2=-41.8kJ/mol;
a.反应体系中,各物质均为气体,则气体的质量不变,且体积恒定,则混合气体密度保持不变,则密度不能判断是否达到平衡的依据,a错误;
b.NO2显红棕色,反应达到平衡时,NO2的浓度不再改变,则混合气体颜色保持不变,b正确;
c.反应中SO3和NO的体积比自始至终保持不变,不能判断是否达到平衡状态,c错误;
d.每消耗1molSO3必然生产1molNO2,不能判断是否达到平衡状态,d错误;
答案为b;
反应体系中,可逆号两边气体计量数的和相等,反应平衡后再加入1molNO2与1molSO2,相当于增大压强体积减小,平衡不移动,SO2的转化率不变;
(3)同一密闭容器中压强之比等于物质的量之比,则3:n=1:0.8,n=2.4mol;
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
初:1 2 0
反:x 2x x
平:1-x 2-2x x
则3-2x=2.4mol,x=0.3mol,v(CH3OH)=0.3mol/(10L×5min)=0.006mol/(L·min);0.3molCO参与反应释放的热量为0.3akJ;
(4)A.反应体系中,左右两边气体计量数的和不相等,容积为恒压,则平衡时气体的物质的量不变,体积不再改变,气体质量一直未变,密度也不变,则平衡时密度不再改变,A正确;
B.该反应的焓变与平衡与否无关,则焓变不能判断是否达到平衡状态,B错误;
C.反应达到平衡时,各物质的物质的量不再改变,图像中t1时各量不再变化,则达到平衡状态,C正确;
D.反应达到平衡时,各物质的物质的量不再改变,则N2O4的转化率不再改变,D正确;
答案为ACD。

【题目】化学小组的同学用如图所示的装置探究二氧化碳的性质后,觉得探究很有意思,想继续探究:

[提出问题]反应后溶液中的溶质有什么?
[查阅资料]
(1)氢氧化钠与二氧化碳反应的化学方程式为___________。
(2)在上述反应中,若二氧化碳过量,能发生如下反应:Na2CO3+H2O+CO2=2NaHCO3。
(3) 2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
[猜想与假设]通过分析,小明做出如下猜想:①含有氢氧化钠和碳酸钠;②含有碳酸钠和碳酸氢钠。
[实验探究]为确定反应后溶液的组成,同学进行了如下两项探究活动:
(1) 对相关物质性质的研究:
碳酸氢钠溶液 | 氢氧化钠溶液 | 碳酸钠溶液 | |
加入稀盐酸 | 产生气泡 | 无明显变化 | 产生气泡 |
加入饱和石灰水 | 溶液变浑浊 | 溶液变浑浊 | 现象Ⅰ |
加入氯化钙溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 | 澄清石灰水无明显变化 |
上表中现象Ⅰ对应的化学方程式为__________________。
(2)探究反应后溶液的成分:为确认反应后溶液的组成,小明设计了如下实验过程
实验步骤 | 操作 | 实验现象 | 实验结论 |
① | 取一定量反应后溶液放入试管中,滴加适量的氯化钙溶液 | 有沉淀产生 | —— |
② | 将步骤①所得的混合物过滤、洗涤,并将滤渣分成两部分 | —— | —— |
③ | 向其中一份步骤②所得固体中滴加稀盐酸 | 有气泡产生 | 原溶液中含有______ |
④ | 取另一份步骤②所得固体,_____ | _____ | _____ |
[反思与评价]
(1)若想直接证明小明的另一个猜想不正确,在上述方案的基础上,应加做的实验是_______。
(2)小伟提出,小明的猜想不完全,反应后溶液的组成还可能是_______(有几种写几种)。