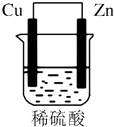
题目内容
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
B. 60g丙醇中存在的共价键总数为10NA
C. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D. 235g![]() U发生裂变反应:
U发生裂变反应: ![]() U+
U+![]() n
n![]()
![]() Sr+
Sr+![]() U+10
U+10![]() n净产生的中子(
n净产生的中子(![]() n)数为10NA
n)数为10NA
【答案】C
【解析】A、HCO3-在溶液中能电离为CO32-和水解为H2CO3,根据物料守恒可知,溶液中的HCO3-、CO32-、H2CO3之和为0.1NA个,故A错误;B、60g丙醇的物质的量为1mol,而丙醇中含11条共价键,故1mol丙醇中含11NA条共价键,故B错误;C、过氧化钠与水反应时,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故C正确;D、92235U+01n![]() 3890Sr+54136U+1001n净产生的中子为10-1=9个,则235g核素92235U发生裂变反应净产生的中子(01n)数为9NA,故D错误;故选C。
3890Sr+54136U+1001n净产生的中子为10-1=9个,则235g核素92235U发生裂变反应净产生的中子(01n)数为9NA,故D错误;故选C。

【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2
FeO(s)+H2(g) ΔH2,平衡常数为K2
在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)是_________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图1所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图1所示:

①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol/L,则平衡时CO2的浓度为________mol/L。
②下列措施中能使平衡时CO物质的量百分数增大的是________(填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
(3)对于可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2。
FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2。
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是______。
A.升温 B.增大CO2浓度 C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的v逆变化曲线_________________________。