题目内容
【题目】元素周期表中第三、四周期的某些元素在生产、生活中有着广泛的应用。
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①钒的价电子排布图是___________;
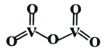
②V2O5是一种常见的催化剂,常用在SO2转化为SO3的反应中。V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为____________;若将V2O5溶解在NaOH溶液中,可得到锐酸钠(Na3VO4),该盐中阴离子的立体构型为_____________,写出与VO43-空间构型相同的一种阳离子____________(填化学式)。
(2)氯化铝在有机化学中有很广泛的应用。无水氯化铝在177.8℃时升华,蒸气或熔融状态以Al2Cl6形式存在。下列关于氯化铝的推断错误的是_______。
a.氯化铝是分子晶体 b.Al2Cl6中Al是sp2杂化
c.氯化铝难溶于有机溶剂 d.Al2Cl6中存在配位键
(3)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:r(Fe2+)为61pm,r(Co2+)为65pmo在隔绝空气条件下分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是_________________________。
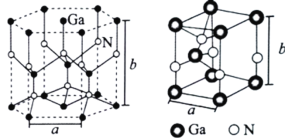
(4)GaN是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaN晶胞结构如图所示。已知六棱柱底边边长为acm,高为bcm,阿伏加德罗常数的值为NA。则晶胞中Ga原子采用的密堆积方式为______________,每个Ga原子周围距离最近的Ga原子数目为____;GaN的密度为_____________gem-3(用含a、b、NA的代数式表示)。
【答案】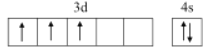 3:2 正四面体 NH4+ bc r(Fe2+)<r(Co2+),晶格能FeO>CoO,FeCO3比CoCO3易分解 六方最密堆积方式 12
3:2 正四面体 NH4+ bc r(Fe2+)<r(Co2+),晶格能FeO>CoO,FeCO3比CoCO3易分解 六方最密堆积方式 12 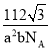
【解析】
(1)①钒是23号元素,外围5个电子排布于3d、4s轨道上,价电子排布式为3d34s2;
②根据图1可知,V2O5分子中含有6个σ键和4个π键;VO43-中V原子的价层电子对数=4+![]() =4,无孤电子对,VSEPR模型为正四面体;
=4,无孤电子对,VSEPR模型为正四面体;
(2)根据氯化铝的熔点确定其晶体类型,熔点较低的化合物一般为分子晶体,二聚物Al2Cl6中Al有4个Al-Cl键、含有配位键,氯化铝是非极性分子、易溶于有机溶剂;
(3)不溶性碳酸盐分解的过程实质是金属阳离子与碳酸根中的氧离子结合的过程,金属阳离子半径越小、与氧离子形成的离子键越强,碳酸盐分解的温度越低;
(4)Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为12;晶胞中Ga原子数为1+4×![]() +4×
+4×![]() =2,N原子数为1+2×
=2,N原子数为1+2×![]() +2×
+2×![]() =2,晶胞的质量m=
=2,晶胞的质量m=![]() g,根据密度公式计算晶体密度。
g,根据密度公式计算晶体密度。
(1)①钒是23号元素,核外有23个电子,价电子排布式为3d34s2,价电子排布图是![]() ;
;
②根据图1可知,V2O5分子中含有4个V=O双键和2个VO单键,一个双键含有1个σ键和1个π键,单键均为σ键,所以V2O5分子中含有6个σ键和4个π键,σ键和π键数目之比为3:2; VO43-中V原子的价层电子对数=4+![]() =4,无孤电子对,VSEPR模型和空间构型均为正四面体,所以与VO43-空间构型相同的一种阳离子为NH4+;
=4,无孤电子对,VSEPR模型和空间构型均为正四面体,所以与VO43-空间构型相同的一种阳离子为NH4+;
(2)a.氯化铝熔点较低,所以为分子晶体,故a正确;
b.Al的价层电子对数为4,采用sp3杂化,故b错误;
c.氯化铝是非极性分子、易溶于水和有机溶剂,故c错误;
d.蒸气或熔融状态以Al2Cl6形式存在,氯化铝中铝原子最外层电子只有3个电子,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供,所以含有配位键,故d正确;
故答案为:bc;
(3)不溶性碳酸盐分解的过程实质是金属阳离子与碳酸根中的氧离子结合的过程,金属阳离子半径越小,形成的氧化物晶格能越大、物质越稳定,由于r(Fe2+)<r(Co2+),所以FeCO3的分解温度低于CoCO3;
(4)晶胞图中Ga原子采用六方最密堆积方式,以结构单元上底面面心的Ga原子研究,上底面6个顶点Ga原子、内部的3个Ga原子之距离最近且相等,与上底面共面的结构单元内还有3个Ga原子,故每个Ga原子周围距离最近的Ga原子数目为12;晶胞中Ga原子数为1+4×![]() +4×
+4×![]() =2,N原子数为1+2×
=2,N原子数为1+2×![]() +2×
+2×![]() =2,晶胞的质量m=
=2,晶胞的质量m=![]() g,晶胞体积V=2×
g,晶胞体积V=2×![]() sin60a2bcm3=
sin60a2bcm3=![]() a2bcm3,晶体密度ρ=
a2bcm3,晶体密度ρ=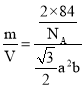 gcm3=
gcm3=![]() g/cm3。
g/cm3。