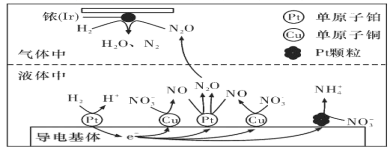
题目内容
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。下列说法正确的是( )
标注。下列说法正确的是( )
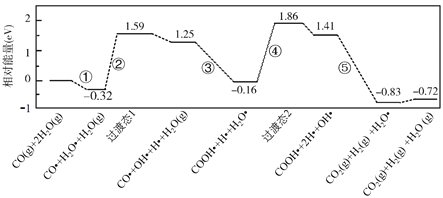
A.水煤气变换反应的ΔH>0
B.步骤③的化学方程式为:CO●+OH●+H2O(g)=COOH●+H2O●
C.步骤⑤只有非极性键H-H键形成
D.该历程中最大能垒(活化能)E正=1.70eV
【答案】B
【解析】
图象分析可知水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,正反应进行的方向需要吸收能量,结合图此分析判断,该历程中最大能垒(活化能)E正,得到反应的化学方程式。
A.图象分析可知水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,反应的焓变ΔH小于0,故A错误;
B.结合此图分析判断,③是发生的过渡反应:CO●+OH●+H2O(g)=COOH●+H2O●,故B正确;
C.步骤⑤中H-O键原反应物中已经存在,则形成的化学键包括极性键C=O,非极性键H-H键形成,故C错误;
D.该历程中最大能垒(活化能)E正=1.86eV-(-0.16eV)=2.02eV,故D错误;
故答案为B。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
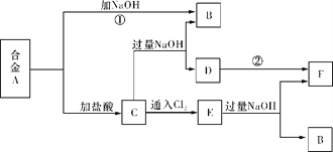
蓝天教育暑假优化学习系列答案【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
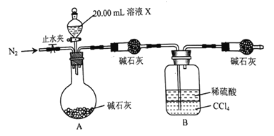
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定该盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100mL0.10mol/LNaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)__→洗涤(并将洗涤液移入容量瓶)→__→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、___、__。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___。
②根据上述数据,可计算出该盐酸的浓度约为__(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:___。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失