题目内容
3.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1 451kJ•mol-1 I3=7 733kJ•mol-1 I4=10 540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
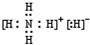 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为

该同学所画的电子排布图违背了泡利原理.
(4)G位于ⅦB族d区,该元素的核外电子排布式为[Ar]3d54s2.
(5)检验F元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
分析 A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,
A元素的核外电子数和电子层数相等,A为H元素;
B元素原子的核外p电子数比s电子数少1,B有2个电子层,为1s22s22p3,故B为N元素;
由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;
D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;
E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;
F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素,
G在第四周期周期表的第7列,G为Mn元素.
解答 解:A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,
A元素的核外电子数和电子层数相等,A为H元素;
B元素原子的核外p电子数比s电子数少1,B有2个电子层,为1s22s22p3,故B为N元素;
由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;
D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;
E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;
F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素,
G在第四周期周期表的第7列,G为Mn元素.
(1)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为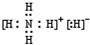 ,故答案为:
,故答案为: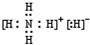 ;
;
(2)B为N元素,核外电子排布式为1s2ns2np3,基态原子中能量最高的电子,处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈纺锤形,
故答案为:3;纺锤;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为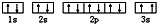 ,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利原理,
,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利原理,
故答案为:泡利原理;
(4)G为Mn元素,是25号元素,位于第四周期第ⅦB族,最后填充的为d电子,为d区元素,电子排布式为[Ar]3d54s2,
故答案为:ⅦB;d;[Ar]3d54s2;
(5)F为K元素,检验F元素的方法是焰色反应,产生此现象的原因是当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量,
故答案为:焰色反应;当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
点评 本题考查结构性质与位置关系、核外电子排布规律、电子式、杂化轨道理论、元素周期表等,综合性较大,难度中等,推断元素是解题的关键,注意基础知识的掌握.

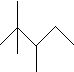 ,有机物B与等物质的量的H2发生加成反应可得到A,下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到A,下列有关说法错误的是( )| A. | A的最简式为C4H9 | |
| B. | A的一氯代物有5种 | |
| C. | A有许多同分异构体,其中主链碳数为5有机物有5种(不包括A) | |
| D. | B的结构可能有3种,其中一种名称为:2,2,3-三甲基-3-戊烯 |
| X | ||
| Y | ||
| Z |
| A. | X是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| B. | Y是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| C. | Z是较活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| D. | Y单质的氧化性比Z单质的氧化性弱 |
| A. | O、Cl、S、P | B. | K+、Mg2+、Al3+、H+ | ||
| C. | Ca2+、Mg2+、Al3+、K+ | D. | I-、Br-、Cl-、F- |
| A. | 过氧化钠 | B. | 二氧化硫 | C. | 盐酸 | D. | 氯气 |
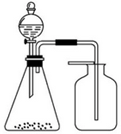
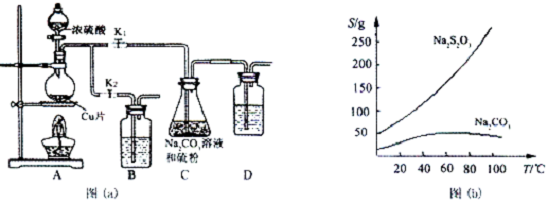
| A. | 浓氨水与固体CaO | B. | 稀盐酸与石灰石 | C. | 稀硝酸与铜片 | D. | 浓盐酸与MnO2 |
| A. | CH3-CH═CH2与 | B. | 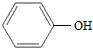 与 与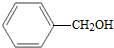 | ||
| C. | CH3COOCH3与CH3CH2COOCH3 | D. | CH3CH2Cl与CH3CHCl-CH2Cl |
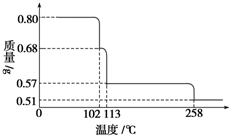 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.