题目内容
3.为了达到下表中的实验目的,请从“供选择的化学试剂及方法”栏中,选择正确的选项的字母代号填入对应的空格中.| 序 号 | 实 验 目 的 | 答案 | 供选择的化学试剂及方法 |
| (1) | 实验室检验二氧化碳气体 | F | A让激光透过 B 滴入无色KSCN溶液 C抽少许纱,灼烧 D新制的Cu(OH)2,加热 E通过盛溴水的洗气瓶 F通入澄清石灰水中 |
| (2) | 鉴别溶液和胶体 | A | |
| (3) | 化验糖尿病 | D | |
| (4) | 鉴别Fe2+和Fe3+ | B | |
| (5) | 识别棉织品和毛织品 | C |
分析 (1)二氧化碳可使澄清石灰水变浑浊;
(2)胶体具有丁达尔效应;
(3)可用新制的Cu(OH)2浊液鉴别葡萄糖;
(4)Fe3+可用KSNC溶液鉴别;
(5)毛织品含有蛋白质,可用灼烧法检验.
解答 解:(1)二氧化碳可使澄清石灰水变浑浊,一般用澄清石灰水鉴别,故答案为:F;
(2)胶体具有丁达尔效应,让一束光透过可形成光路,故答案为:A;
(3)糖尿病病人尿液中含有较多葡萄糖,葡萄糖与新制氢氧化铜在加热条件下反应生成砖红色沉淀,故答案为:D;
(4)Fe3+可用KSNC溶液鉴别,溶液变红色,故答案为:B;
(5)毛织品含有蛋白质,可用灼烧法检验,故答案为:C.
点评 本题考查物质的检验和鉴别,综合考查化学知识的应用以及元素化合物知识,为高考常见题型,注意把握物质的性质的异同.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
13.下列说法正确的是( )
| A. | 打开盛浓盐酸的试剂瓶可看到白色的酸雾,这说明HCl不稳定 | |
| B. | 蔗糖中滴入浓硫酸,蔗糖变黑,这说明浓硫酸是氧化性酸 | |
| C. | 向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| D. | 碳酸、亚硫酸和次氯酸都是不稳定性酸 |
14.碳及其化合物的开发利用已成为科学家研究的重要课题,在工农业生产和科学研究中有十分重要的地位.
Ⅰ:草酸钙晶体(CaC2O4•H2O)可用作分离稀有金属的载体.
(1)在一定温度下向1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=0.04mol•L-1•min-1;当反应达到平衡后,将容器体积压缩为0.5L,一段时间后反应再次达到平衡,则下列说法正确的是CD(填答案选项编号).
A.压缩容器体积,CaC2O4的分解率增大
B.平衡移动后,该反应的化学平衡常数减小
C.平衡移动后,CO和CO2的浓度都没有改变
D.平衡移动后,CaO的质量减少
(2)某温度下数据:Kφ(CaC2O4)=5.0×10-9;Kφ(CaCO3)=2.5×10-9
向0.6mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:
CO32-(aq)+CaC2O4(s)?CaCO3(s)+C2O42-(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42-)=0.4mol•L-1.
Ⅱ.甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0其他条件相同时,在相同时间内,反应分别在不同催化剂(Ⅰ、Ⅱ、Ⅲ)或不同温度下反应,测得CH4的转化率变化如图所示.
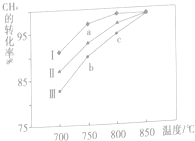
(1)在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
(2)a点v正(CH4)大于v逆(CO)(填写“大于”、“小于”或“等于”).
(3)c点CH4的转化率高于b点,原因是b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高.
Ⅲ.工业上用焦炭与水蒸气在高温下制取水煤气,在化工生产中有重要用途.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:
C(s)+2H2O(g)?CO2(g)+2H2(g).其相关数据如表所示:
(1)温度T2>T1的理由是甲乙两容器中反应物浓度相同,乙达到平衡所有时间短,说明T2温度高.
(2)该反应达到平衡后,升高温度,H2O(g)的转化率变小(填写“变大”、“变小”).
Ⅰ:草酸钙晶体(CaC2O4•H2O)可用作分离稀有金属的载体.
(1)在一定温度下向1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=0.04mol•L-1•min-1;当反应达到平衡后,将容器体积压缩为0.5L,一段时间后反应再次达到平衡,则下列说法正确的是CD(填答案选项编号).
A.压缩容器体积,CaC2O4的分解率增大
B.平衡移动后,该反应的化学平衡常数减小
C.平衡移动后,CO和CO2的浓度都没有改变
D.平衡移动后,CaO的质量减少
(2)某温度下数据:Kφ(CaC2O4)=5.0×10-9;Kφ(CaCO3)=2.5×10-9
向0.6mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:
CO32-(aq)+CaC2O4(s)?CaCO3(s)+C2O42-(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42-)=0.4mol•L-1.
Ⅱ.甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0其他条件相同时,在相同时间内,反应分别在不同催化剂(Ⅰ、Ⅱ、Ⅲ)或不同温度下反应,测得CH4的转化率变化如图所示.

(1)在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
(2)a点v正(CH4)大于v逆(CO)(填写“大于”、“小于”或“等于”).
(3)c点CH4的转化率高于b点,原因是b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高.
Ⅲ.工业上用焦炭与水蒸气在高温下制取水煤气,在化工生产中有重要用途.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:
C(s)+2H2O(g)?CO2(g)+2H2(g).其相关数据如表所示:
| 容积 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O | H2 | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
(2)该反应达到平衡后,升高温度,H2O(g)的转化率变小(填写“变大”、“变小”).
11.下列反应属于氧化还原反应的是( )
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | ||
| C. | NH3+HCl═NH4Cl | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑ |
8.根据右表提供的数据可知,在溶液中能大量共存的微粒组是( )
| 化学式 | 电离常数 |
| CH3COOH | K=1.7×10-5 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、CN- | B. | HCO3-、CH3COOH、CN-、CO32- | ||
| C. | HCN、HCO3-、CN-、CO32- | D. | HCN、HCO3-、CH3COO-、CN- |
15.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 3.0 L 0.1 mol•L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7: c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) | |
| C. | 常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则原醋酸溶液醋酸的电离度为1% | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
12.随着科技发展,新型电池层出不穷.图1为肼(N2H4)燃料电池,图2为光伏并网发电装置.LED(半导体照明)是由GaN芯片和钇铝石榴石(YAG,化学:Y3Al5O12)芯片装在一起而做成,其在运动会场馆内也随处可见.下列有关说法中正确的是( )
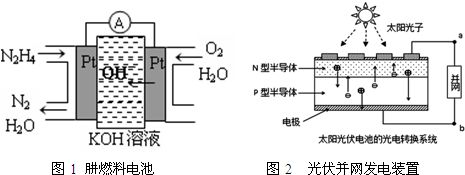

| A. | 氢氧燃料电池、太阳光伏电池中都利用了原电池原理 | |
| B. | 图1左边电极上发生的电极反应式为:N2H4-4e-+4OH-=N2+4H2O | |
| C. | 图2中N型半导体为正极,P型半导体为负极 | |
| D. | LED中的Ga和Y不可能都显+3价 |
13.稀土元素号称“工业维生素”,科学家把稀土元素镧对作物的作用赋予“超级钙”的美称.已知镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3,La(OH)3是不溶于水的弱碱,而LaCl3、La(NO3)3都可溶于水,下列说法中正确的是( )
| A. | La(NO3)3水溶液显酸性 | |
| B. | LaCl3的水溶液加热蒸发灼烧,最终得到无水LaCl3 | |
| C. | La和盐酸反应的离子方程式为:La+2H+=La3++H2↑ | |
| D. | 镧有两种核素:57139La和放射性57138La,由此可知镧元素的相对原子质量为138.5 |