题目内容
【题目】工业上,常用Fe2(SO4)3溶液作腐蚀液,腐蚀铜质电路板得到废液主要成分是FeSO4和CuSO4,含少量Fe2(SO4)3。某小组设计装置从废液中提取铜,如图:

已知:Fe2+失电子能力比OH-强。下列说法正确的是
A. 电解初期阴极没有铜析出,原因是2H+ + 2e- = H2↑
B. 石墨极的电极反应式为2H2O + 4e- = 4H+ + O2↑
C. 若将废液2充入阳极室时可再生腐蚀液(硫酸铁溶液)
D. 若电路中转移2mol电子,理论上有2molM从交换膜左侧向右侧迁移
【答案】C
【解析】
A.电解初期,浸取液中含过量的铁离子,铁离子氧化性大于铜优先放电,电极反应Fe3++e-═Fe2+,阴极没有铜析出,故A错误;B. 石墨极为阳极,发生氧化反应,溶液中的氢氧根离子放电,电极反应式为4OH――4e-=2H2O+O2↑,故B错误;C. 废液2中主要含有硫酸亚铁,若将废液2充入阳极室,由于Fe2+失电子能力比OH-强,阳极的电极反应式为Fe2+-e-═Fe3+,SO42-通过阴离子交换膜进入阳极室,可再生腐蚀液(硫酸铁溶液),故C正确;D. 若电路中转移2mol电子,阳极室减少2mol氢氧根离子,理论上有1mol SO42-从交换膜左侧向右侧迁移,故D错误;故选C。

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的电子式是____________,其含有的化学键类型___________
(3)最高价氧化物是两性氧化物的素是________;写出它的氧化物与盐酸反应的离子方程式_________________________________________
(4)写出元素③的氢化物的电子式______________
(5)写出④的单质与水反应的离子方程式________________________________________
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备及 A 中酒精灯已略)。
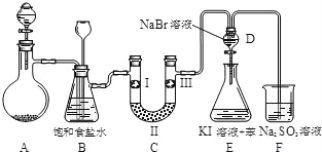
(1)实验室制氯气的离子方程式为_____。
(2)装置 B 中饱和食盐水的作用是_____;请写出装置 B 的另一个作用_______________________________。
(3)装置 C 的实验目的是验证氯气是否具有漂白性, 为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是_______________(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置 D、E 的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置 D 中少量溶液加入装置 E 中,振荡,静置,观察到的现象是_____,该现象不能说明溴的非金属性强于碘,原因是_________。
(5)装置 F 中所发生的离子反应方程式:_____。
