��Ŀ����
����Ŀ����ѧ����������������ء��밴Ҫ�ش��������⣺
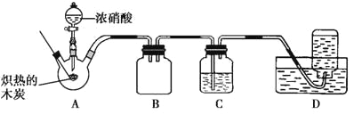
(1)K2FeO4 ��һ����Ҫ�ľ�ˮ�����������з����Ƶã�2Fe(OH)3 + 3Cl2 + 10KOH![]() 2K2FeO4 + 6KCl + 8H2O�ڸ÷�Ӧ�У���ԭ����____________������Ӧ���� 1mol K2FeO4 ����ʱ��ת�Ƶ��ӵ���ĿΪ___________��
2K2FeO4 + 6KCl + 8H2O�ڸ÷�Ӧ�У���ԭ����____________������Ӧ���� 1mol K2FeO4 ����ʱ��ת�Ƶ��ӵ���ĿΪ___________��
(2)��ͭƬͶ��ʢ��ϡ������Թ�����Ӧ����������������ؾ����ͭƬ�ܽ⡣�������ӷ���ʽ��ʾ���е�ԭ��____________��
(3)������ˮ�����������²�����ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽ��_____��
(4)�����У���������Ũ��ˮ�����������ܵ��Ƿ�©������������ܵ�ij��©������Ũ��ˮ���ʱ�ͻ�������̵�������֪�˷�ӦΪ�е������ɵ��û���Ӧ����ѧ����ʽΪ______��
���𰸡�Fe(OH)3 3NA 3Cu +2NO3-+ 8H+ ==3Cu2++2NO��+ 4H2O ![]() 8NH3+3Cl2====N2+6NH4Cl
8NH3+3Cl2====N2+6NH4Cl
��������
��1���÷�Ӧ��FeԪ�صĻ��ϼ���+3������Ϊ+6�ۣ�������������Fe(OH)3�ǻ�ԭ��������1molK2FeO4ת��3mol�ĵ��ӣ�
��2�����������£���������Ӿ���ǿ�����ԣ���������ͭ����NO��
��3����ˮ�к�HClO�������·�����Ӧ![]() ��
��
��4�������Ͱ�������������ԭ��Ӧ���ɵ������Ȼ�李�
��1��2Fe(OH)3 +3Cl2 +10KOH![]() 2K2FeO4+6KCl +8H2O��Ӧ�У�FeԪ�صĻ��ϼ���+3������Ϊ+6�ۣ�������������Fe(OH)3�ǻ�ԭ��������1molK2FeO4ת��3mol�ĵ��ӣ�ת�Ƶ��ӵ���ĿΪ3NA���ʴ�Ϊ��Fe(OH)3��3NA��
2K2FeO4+6KCl +8H2O��Ӧ�У�FeԪ�صĻ��ϼ���+3������Ϊ+6�ۣ�������������Fe(OH)3�ǻ�ԭ��������1molK2FeO4ת��3mol�ĵ��ӣ�ת�Ƶ��ӵ���ĿΪ3NA���ʴ�Ϊ��Fe(OH)3��3NA��
��2�����������£���������Ӿ���ǿ�����ԣ���������ͭ����NO����Ӧ�����ӷ���ʽΪ��3Cu+2NO3-+8H+=3Cu2++2NO��+4H2O���ʴ�Ϊ��3Cu+2NO3-+8H+=3Cu2++2NO��+4H2O��
��3��������ˮ�����������£������ᷢ���ֽ������������������Ӧ����ʽΪ��2HClO=2HCl+O2�����ʴ�Ϊ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��4�������Ͱ�������������ԭ��Ӧ���ɵ������Ȼ�泥���Ӧ�Ļ�ѧ����ʽΪ8NH3+3Cl2=N2+6NH4Cl���ʴ�Ϊ��8NH3+3Cl2=N2+6NH4Cl��