题目内容
【题目】在下列曲线中,纵坐标表示生成Al(OH)3的质量,横坐标表示加入试剂的体积。下列叙述中不正确的是( )
A. 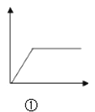 图①可表示向NH3·H2O中滴加AlCl3溶液至过量
图①可表示向NH3·H2O中滴加AlCl3溶液至过量
B. 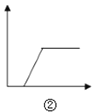 图②可表示向NaOH与NaAlO2的混合溶液中通入CO2至过量
图②可表示向NaOH与NaAlO2的混合溶液中通入CO2至过量
C. 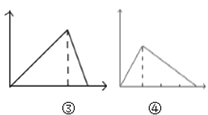 图③可表示向NaOH与NaAlO2的混合液中滴加HCl溶液至过量;而图④可表示向盐酸酸化的AlCl3溶液中滴加NaOH至过量
图③可表示向NaOH与NaAlO2的混合液中滴加HCl溶液至过量;而图④可表示向盐酸酸化的AlCl3溶液中滴加NaOH至过量
D. 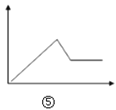 图⑤可表示向MgCl2和AlCl3的混合液中滴加NaOH溶液至过量
图⑤可表示向MgCl2和AlCl3的混合液中滴加NaOH溶液至过量
【答案】C
【解析】
A、NH3·H2O是弱碱,不能溶解氢氧化铝,向NH3·H2O中滴加AlCl3溶液至过量:AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl,对照图象应为①,A正确;
B、向NaOH与NaAlO2的混合溶液中通入CO2气体:先发生2NaOH+CO2=2H2O+Na2CO3;后逐渐产生沉淀,NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,对照图象应为②,B正确;
C、向NaOH与NaAlO2的混合液中滴加HCl溶液至过量,盐酸首先中和氢氧化钠,然后开始产生氢氧化铝沉淀,盐酸过量后沉淀溶解,图像均不满足;向盐酸酸化的AlCl3溶液中滴加NaOH至过量,氢氧化钠首先中和盐酸,然后沉淀铝离子产生氢氧化铝沉淀,过量后沉淀又溶解,图像均不满足,C错误;
D、向MgCl2和AlCl3的混合液中滴加NaOH溶液至过量,先是生成氢氧化镁和氢氧化铝沉淀,后是氢氧化铝溶解,对照图象应为⑤,D正确;
答案选C。

【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路、陶瓷等生产领域。工业上由氧化铝与焦炭在氮气流中高温制得:Al2O3+3C+N2![]() 2AlN+3CO。请回答:
2AlN+3CO。请回答:
(1)上述反应中氧化剂与还原剂的物质的量之比___________________。
(2)制得的氮化铝产品中常含有Al4C3、Al2O3和C等杂质,已知:
稀硫酸(过量) | 浓NaOH溶液(过量) | |
AlN | 2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4 | AlN+NaOH+H2O=NaAlO2+NH3 ↑ |
Al4C3 | Al4C3+6H2SO4=2Al2(SO4)3+3CH4 ↑ | Al4C3+4NaOH+4H2O=4NaAlO2+3CH4 ↑ |
为测定产品中AlN和Al4C3的含量,设计了如下两套实验装置(在通风橱进行,可适当微热,忽略空气中水蒸气、CO2的影响及NH3在强碱性溶液中的溶解)。

装置I、II在反应前后的质量差分别为m1 g和m2 g,则m g产品中AlN的质量分数为______(用含m、m1、m2的代数式表示)。
(3)取装置I中反应后的滤液,先加入少量(NH4)2SO4溶液,然后依次进行蒸发浓缩、冷却结晶、过滤、用少量酒精洗涤、滤纸吸干,得到铵明矾晶体[NH4Al(SO4)2·12H2O]。
①蒸发浓缩操作时,除需铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒外,还需要_______(填仪器名称);蒸发浓缩的操作;小火加热,不断搅拌,_________。
②用少量酒精洗涤的目的__________________________。
(4)已知:25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.8×10-5,Kb(Al(OH)3]=1.4×10-9。
① NH4Al(SO4)2溶液中离子浓度由大到小的顺序_________________。
②(NH4)2SO4溶液中存在水解平衡,则水解平衡常数为_____________。