题目内容
5.铁是地球表面最丰富的金属之一,能形成多种配合物.(1)Fe3+可以与SCN-、CN-、有机分子等形成很多的配合物.
①写出基态Fe3+的核外电子排布式1s22s22p63s23p63d5.
②写出一种与SCN-互为等电子体,且为非极性分子的化学式CO2.
(2)实验室在碱性条件下用氯化亚铁和环戊二烯(
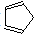 )合成二茂铁.环戊二烯中碳原子的杂化方式为sp2、sp3;1mol环戊二烯中含有的σ键数目为11NA.
)合成二茂铁.环戊二烯中碳原子的杂化方式为sp2、sp3;1mol环戊二烯中含有的σ键数目为11NA.(3)普鲁士蓝俗称铁蓝,结构如图1所示(K+未画出),平均每两个立方体中含有一个K+离子.已知:普鲁士蓝中铁元素的化合价有+2和+3两种,其中Fe3+与Fe2+的个数比为:1:1.
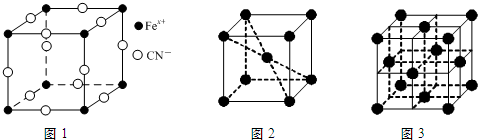
(4)在一定条件下铁形成的晶体的基本结构单元如图2和图3所示,则图2和图3的结构中铁原子的配位数分别为8、12.
分析 (1)①Fe元素原子失去4s能级2个电子及3d能级1个电子形成Fe3+;
②原子个数相等且价电子数相等的分子或离子为等电子体;
(2)环戊二烯分子中碳碳双键两端的碳原子σ键个数是3,碳碳单键之间的C原子σ个数是4;共价化合物中单键为σ,双键中一个是σ键、一个是π键;
(3)利用均摊法确定离子个数之比;
(4)根据均摊法分别计算两种晶体的配位数.
解答 解:(1)①Fe原子核外电子排布为:1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子及3d能级1个电子形成Fe3+,Fe3+的核外电子排布为:1s22s22p63s23p63d5或[Ar]3d5;
故答案为:1s22s22p63s23p63d5;
②SCN-中含有3个原子,且其价电子数是16,与SCN-互为等电子体的一种分子为CO2;
故答案为:CO2;
(2)环戊二烯分子中碳碳双键两端的碳原子σ键个数是3,碳碳单键之间的C原子σ个数是4,所以环戊二烯中C原子采用sp2、sp3杂化;环戊二烯中含3个C-C和2个C=C、6个C-H键,则1mol环戊二烯中含有σ键的数目为11NA;
故答案为:sp2、sp3;11NA;
(3)每隔一个立方体中心有一个钾离子,所以一个晶胞中钾离子个数=1÷2=0.5,该立方体中铁原子个数=8×$\frac{1}{8}$=1,CN-位于每条棱中点,该立方体中含有CN-个数=12×$\frac{1}{4}$=3,所以平均化学式是K 0.5 Fe(CN)3,Fe平均化合价2.5,所以亚铁离子与铁离子之比是1:1,
故答案为:1:1;
(4)图2中Fe位于体心和顶点,铁的配位数为8,图3中Fe位于顶点和面心,距离最近的为顶点和面心的铁原子,有12个,所以配位数为12;
故答案为:8、12.
点评 本题考查较为综合,涉及核外电子的排布、等电子体、杂化方式判断、有关晶胞计算,把握电子排布式、杂化类型、晶体的类型是解题关键,题目难度较大.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案| A. | ①②⑤可能 | B. | ④⑥不可能 | C. | ⑤⑥不可能 | D. | 都可能 |
| A. | 用含0.1molFeCl3的溶液与足量沸水反应制得得Fe(OH)3胶体中胶粒数为0.1NA | |
| B. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 将1mol氯气分别通入足量的FeBr2和FeI2溶液中转移电子数均为2NA | |
| D. | 等物质的量的NH4+和OH-含电子数均为10NA |
| 甲 | 乙 | 丙 | |
| A | Na | H2O | Cl2 |
| B | Al | Fe2O3 | 稀H2SO4 |
| C | CH3CH2OH | NaOH溶液 | CH3COOH |
| D | Ba(OH)2溶液 | CO2 | Na2CO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
| 选项 | 仪器 | 试剂 | 实验目的 |
| A | 托盘天平(带砝码)、滴管、量筒、烧杯、药匙、玻璃棒 | 食盐,蒸馏水 | 配制一定物质的量浓度的NaCl溶液 |
| B | 烧杯、漏斗、滴管、铁架台(带铁圈)、玻璃棒、滤纸、导气管 | 烧碱,CO2,稀盐酸 | 除去AlCl3溶液中少量的MgCl2 |
| C | 酸式滴定管、滴管、铁架台(带铁夹) | 已知浓度的盐酸、石蕊 | 测定NaOH溶液的浓度 |
| D | 分液漏斗、烧瓶、锥形瓶、导管、橡皮塞 | 稀盐酸,大理石,硅酸钠溶液 | 证明非金属性:Cl> C>Si |
| A. | A | B. | B | C. | C | D. | D |
| A. | 0.5 mol/L | B. | 1 mol/L | C. | 2 mol/L | D. | 4 mol/L |
| A. | 可向该溶液中加少量CaCO3固体 | |
| B. | 可向该溶液中加入10 mL 0.1 mol/L醋酸溶液 | |
| C. | 可向该溶液中加入少量NaNO3溶液 | |
| D. | 若向该溶液中加入少量醋酸钠固体,反应速率可能变成v(H2)=0.3 mol/(L•h) |
| A. | 多 | B. | 少 | C. | 相等 | D. | 不能确定 |