题目内容
14.某温度下,100mL 0.4mol/L醋酸溶液与足量Zn粒反应生成H2的速率v(H2)=0.01mol/(L•min).为了减缓反应速率,但又不影响生成H2的总量,下列有关说法正确的是( )| A. | 可向该溶液中加少量CaCO3固体 | |
| B. | 可向该溶液中加入10 mL 0.1 mol/L醋酸溶液 | |
| C. | 可向该溶液中加入少量NaNO3溶液 | |
| D. | 若向该溶液中加入少量醋酸钠固体,反应速率可能变成v(H2)=0.3 mol/(L•h) |
分析 为了减缓反应速率,但又不影响生成H2的总量,应使溶液中c(H+)降低,但n((H+))不变,以此解答该题.
解答 解:A.加入CaCO3固体,消耗酸,生成氢气的量减少,故A错误;
B.向该溶液中加入10 mL 0.1 mol/L醋酸溶液,n((H+))增大,生成氢气的总量增大,故B错误;
C.加入少量NaNO3溶液,生成NO气体,故C错误;
D.向该溶液中加入少量醋酸钠固体,氢离子浓度降低,反应速率减小,故D正确.
故选:D.
点评 本题考查化学反应速率的影响因素,为高考常见题型,难度不大,注意把握影响化学反应速率的因素以及原因的探究,答题时注意审题.

练习册系列答案
相关题目
4.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+═Mn2++CO2↑+H2O(未配平)用4mL 0.001mol•L-1KMnO4溶液与2mL 0.01mol•L-1H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如表:
(1)该反应中氧化剂和还原剂的物质的量之比为2:5.
(2)如果研究催化剂对化学反应速率的影响,使用实验Ⅰ和Ⅱ(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ.
(3)对比实验I和IV,可以研究浓度对化学反应速率的影响,实验IV中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
| 实验 | 硫酸(10%)体积/mL | 温度/℃ | 其他物质 |
| I | 2mL | 20 | / |
| II | 2mL | 20 | 10滴饱和MnSO4溶液 |
| III | 2mL | 30 | / |
| IV | 1mL | 20 | 1mL蒸馏水 |
(2)如果研究催化剂对化学反应速率的影响,使用实验Ⅰ和Ⅱ(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ.
(3)对比实验I和IV,可以研究浓度对化学反应速率的影响,实验IV中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
2.沸点最低的烷烃X和它的某一种同系物Y以2:1的气体体积比混合,其密度与X相邻同系物相等(同温同压),则Y的可能结构简式是( )
| A. | CH3(CH2)3CH3 | B. | CH3CH2CH(CH3)CH3 | C. | CH3CH2CH3 | D. | CH3CH(CH3)CH3 |
9.实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂.发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末不可能是( )
| A. | Fe2O3和MnO2 | B. | Fe2O3和V2O5 | C. | Cr2O3和V2O5 | D. | Fe3O4和FeO |
19.从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:

则下列说法正确的是( )

则下列说法正确的是( )
| A. | 试剂a是铁、试剂b是稀硫酸 | |
| B. | 操作I、操作Ⅱ、操作Ⅲ所用仪器相同 | |
| C. | 试剂c是氯气,相应的反应为:2Fe2++Cl2═2Cl-+2Fe3+ | |
| D. | 用酸性KMnO4溶液可检验溶液W中是否还有Fe2+ |
6.下列对实验事故或药品的处理方法正确的是( )
| A. | 实验台上的酒精灯被碰翻着火,立即用湿抹布扑灭 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器扑灭 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氨水冲洗 | |
| D. | 将含硫酸的废液直接倒入水槽,用水冲入下水道 |
3.下列操作达不到预期目的是( )
①石油分馏时把温度计插入受热的液体中
②用酸性高锰酸钾溶液除去乙炔中含有的H2S
③用溴乙烷与氢氧化钠溶液加热制取乙烯
④将苯和溴水混合后加入铁粉制取溴苯
⑤将敞口久置的电石与蒸馏水混合制乙炔.
①石油分馏时把温度计插入受热的液体中
②用酸性高锰酸钾溶液除去乙炔中含有的H2S
③用溴乙烷与氢氧化钠溶液加热制取乙烯
④将苯和溴水混合后加入铁粉制取溴苯
⑤将敞口久置的电石与蒸馏水混合制乙炔.
| A. | 只有①⑤ | B. | 只有③④⑤ | C. | 只有①②③⑤ | D. | ①②③④⑤ |
4.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验或说法不合理的是( )
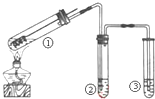

| A. | 上下移动①中铜丝可控制SO2的量 | |
| B. | ②中选用品红溶液验证SO2的生成,③中选用NaOH溶液吸收多余的SO2 | |
| C. | 由于SO2易溶于水,实验时易发生倒吸现象,在①与②之间可加装防倒吸装置 | |
| D. | 为确认CuSO4生成,向①中加水,观察颜色 |
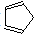 )合成二茂铁.环戊二烯中碳原子的杂化方式为sp2、sp3;1mol环戊二烯中含有的σ键数目为11NA.
)合成二茂铁.环戊二烯中碳原子的杂化方式为sp2、sp3;1mol环戊二烯中含有的σ键数目为11NA.