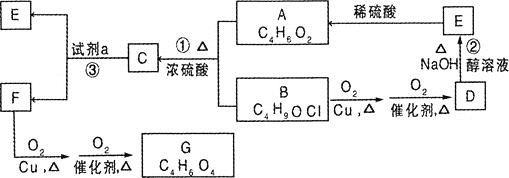
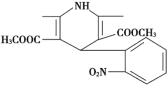
题目内容
【题目】已知:A(g)+3B(g)![]() 2C(g)△H<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是( )
2C(g)△H<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是( )
A.甲中达平衡时,用B的浓度变化表示5min内的平均反应速率为0.15 molL-1min-1
B.乙中的热化学方程式为2C(g)![]() A(g)+3B(g):△H=+4/3Q2 kJ/mol
A(g)+3B(g):△H=+4/3Q2 kJ/mol
C.乙中达到平衡后,再加入0.25molA、0.75molB、1.5molC,与原平衡互为等效平衡,平衡不移动
D.乙中平衡时C的转化率为50%
【答案】B
【解析】
两个容器是等效平衡,两个的热量变化数值之和为反应热的数值,已知Q2=3Q1,说明甲容器消耗了四分之一,转化率为25%。
A.甲中达平衡时,甲容器B的转化率为25%即B消耗了3mol×25%=0.75mol,用B的浓度变化表示5min内的平均反应速率![]() ,故A错误;
,故A错误;
B.根据分析两个容器是等效平衡,两个的热量变化数值之和为反应热的数值,因此乙中的热化学方程式为2C(g)![]() A(g)+3B(g) △H=+
A(g)+3B(g) △H=+ ![]() Q2 kJ/mol,故B正确;
Q2 kJ/mol,故B正确;
C.乙中达到平衡后,再加入0.25molA、0.75molB、1.5molC,用建模思想思考,相当于两个容器都达到平衡后再压缩到一个容器中,平衡正向移动,C百分含量增大,故C错误;
D.甲容器转化率为25%,则乙中平衡时C的转化率75%,故D错误。
综上所述,答案为B。

【题目】碳酸二乙酯(![]() )常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
)常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
化学式 | 熔点/℃ | 沸点/℃ | 物理性质 |
COCl2 | -118 | 8.2 | 微溶于水,溶于芳烃、苯、四氯化碳、氯仿、乙酸等多数有机溶剂,遇水迅速水解,生成氯化氢 |
SO3 | 16.8 | 44.8 | 溶于水,并与水反应生成硫酸和放出大量的热 |
SO2Cl2 | -54.1 | 69.1 | 溶于乙酸、苯,与水反应生成H2SO4和HCl |
CCl4 | -22.9 | 76.8 | 微溶于水,易溶于多数有机溶剂 |
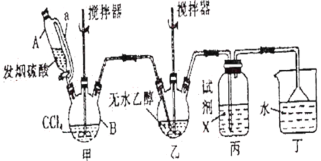
回答下列问题:
(1)甲装置主要用于制备光气(COCl2),先将仪器B中的四氯化碳加热至55~60℃,再缓缓滴加发烟硫酸。
①仪器B的名称是__________。
②仪器A的侧导管a的作用是__________。
(2)试剂X是__________,其作用是__________。
(3)丁装置除了吸收COCl2外,还能吸收的气体是__________(填化学式)。仪器B中四氯化碳与发烟硫酸(用SO3表示)反应只生成两种物质的量为1:1的产物,且均易与水反应,写出该反应化学方程式:__________。
(4)无水乙醇与光气反应生成氯甲酸乙酯,再继续与乙醇反应生成碳酸二乙酯。
①写出无水乙醇与光气反应生成氯甲酸乙酯的化学方程式:__________。
②若起始投入92.0g无水乙醇,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是__________(三位有效数字)