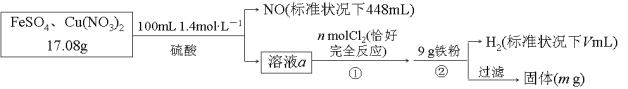
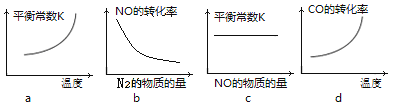
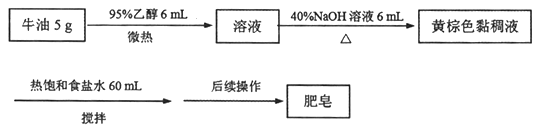
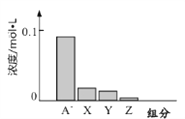
题目内容
【题目】在一定温度下的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的密度不变
②混合气体的压强不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n mol C,同时生成n mol D
⑥单位时间内生成n mol D,同时生成2n mol A
A. ①③⑤ B. ②③④ C. ①③⑥ D. ②⑥
【答案】C
【解析】当物理量由变化到定值时,说明可逆反应到达平衡状态。①![]() ,该反应气体总质量m为变量,恒容容器体积V为定量,则平衡前密度ρ为变量,当ρ不再改变时,反应达平衡状态,故①正确;②pV=nRT,恒温恒容时,p与n成正比,该反应两边气体计量数相等,气体总物质的量n为定量,则压强也为定量,故压强不变不能说明达到平衡状态,故②错误;③平衡前,C的物质的量浓度为变量,当C的物质的量浓度不变时,说明反应达平衡状态,故③正确;④当体系达平衡状态时,容器内A、C、D三种气体的浓度之比可能为2:1:1,也可能不是,故④错误;⑤单位时间内生成nmolC,同时生成nmolD,都体现正方向,未说明正与逆的关系,故⑤错误;⑥单位时间内生成nmolD等效于消耗2nmolA,的同时生成2nmolA,正逆反应相等,达平衡状态,故⑥正确。故选C。
,该反应气体总质量m为变量,恒容容器体积V为定量,则平衡前密度ρ为变量,当ρ不再改变时,反应达平衡状态,故①正确;②pV=nRT,恒温恒容时,p与n成正比,该反应两边气体计量数相等,气体总物质的量n为定量,则压强也为定量,故压强不变不能说明达到平衡状态,故②错误;③平衡前,C的物质的量浓度为变量,当C的物质的量浓度不变时,说明反应达平衡状态,故③正确;④当体系达平衡状态时,容器内A、C、D三种气体的浓度之比可能为2:1:1,也可能不是,故④错误;⑤单位时间内生成nmolC,同时生成nmolD,都体现正方向,未说明正与逆的关系,故⑤错误;⑥单位时间内生成nmolD等效于消耗2nmolA,的同时生成2nmolA,正逆反应相等,达平衡状态,故⑥正确。故选C。

【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:

已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有____。
a.适当升高温度 b.搅拌 c.加适量纯碱 d.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是__________________________。
(3)调节pH为5.4~5.8的目的是______________。
(4)滤渣3的主要成分的化学式是_______。
(5)采用50℃碳化的原因是_________________________________。该过程发生反应的离子方程式是__________________。
(6)检验碳酸锰产品完全洗净的方法是_______________________________。