题目内容
【题目】XYZW是原子序数依次增大的短周期主族元素,Y的一种氢化物可用作制冷剂,XZW形成的化合物在农业上可作杀菌剂,结构如图下列叙述正确的是
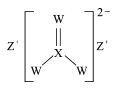
A.W的氧化物的水化物为强酸B.最简单氢化物的沸点:W>Y>X
C.X与W形成的溶剂可溶解硫D.Z与W形成的化合物仅含离子键
【答案】C
【解析】
Y的一种氢化物可用作制冷剂,则Y为N,制冷剂是液NH3;由 可知,Z显+1价,且Z原子序数比Y(N)大,则Z为Na;在
可知,Z显+1价,且Z原子序数比Y(N)大,则Z为Na;在 中X形成4个共价键且原子序数比Y(N)小,则X为C;W原子序数最大且在
中X形成4个共价键且原子序数比Y(N)小,则X为C;W原子序数最大且在 中化合价中为-2价,则W为S;综上所述:X、Y、Z、W分别为:C、N、Na、S,据此解答。
中化合价中为-2价,则W为S;综上所述:X、Y、Z、W分别为:C、N、Na、S,据此解答。
A.W的氧化物的水化物可能为强酸(如SO3的水化物H2SO4为强酸),也可能为弱酸(如SO2的水化物H2SO3为弱酸),A错误;
B.W、Y、X最简单氢化物分别为:H2S、NH3、CH4,对于分子晶体来讲,相对分子质量越大,沸点越高,但NH3分子间存在氢键,沸点在三种氢化物中最高,即三者的最简单氢化物的沸点:Y(NH3) >W(H2S) >X(CH4),B错误;
C.X(C)与W(S)形成的CS2可溶解硫,C正确;
D.Z(Na)与W(S)形成的化合物可能含有共价键,如Na2S2,既含离子键又含共价键,D错误。
答案选C。

练习册系列答案
相关题目