题目内容
4.在一定条件下,将A、B、C三种炔烃所组成的混合气体4g,在催化条件下与足量H2发生加成反应,生成4.4g三种对应的烷烃,则所得烷烃中一定有( )| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
分析 一定条件下三种炔烃组成的混合气体4.0g,与足量的氢气充分加成后可生成4.4g烷烃,则需氢气的质量为4.4g-4.0g=0.4g,n(H2)=$\frac{0.4g}{2g/mol}$=0.2mol,结合n(炔烃)~2n(H2)计算.
解答 解:一定条件下三种炔烃组成的混合气体4.0g,与足量的氢气充分加成后可生成4.4g烷烃,
则需氢气的质量为4.4g-4.0g=0.4g,
n(H2)=$\frac{0.4g}{2g/mol}$=0.2mol,
已知n(炔烃)~2n(H2),
则炔烃的物质的量为0.1mol,
混合炔烃的平均摩尔质量为:$\frac{4.0g}{0.1mol}$=40g/mol,
则混合物中一定含有相对分子质量小于40的炔烃,
则一定含有乙炔,乙炔加成后生成的烷烃为乙烷,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,侧重于有机物分子式的确定,注意掌握平均摩尔质量在化学计算中的应用,明确炔烃与氢气的加成反应原理为解答关键.

练习册系列答案
相关题目
14.下列各组离子,能在溶液中大量共存的是( )
| A. | H+、Ca2+、CO32-、Cl- | B. | Na+、Mg2+、SO42-、OH- | ||
| C. | K+、Na+、OH-、Cl- | D. | Cu2+、Ba2+、Cl-、SO42- |
15.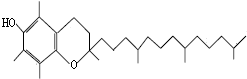 蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
 蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )| A. | 维生素E的化学式为:C29H50O2 | |
| B. | 维生素E的还原性主要是酚羟基表现出来,若被酯化后就不具有抗氧化活性 | |
| C. | 维生素E易溶于水和乙醇、苯等有机溶剂 | |
| D. | 维生素E虽含有酚羟基,但不能与溴水反应 |
12.化学反应C(s)+H2O(g)?CO(g)+H2(g)(正反应为吸热反应)达到平衡,下列叙述中正确的是( )
| A. | 扩大容器的容积,平衡向正反应方向移动 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 加入水蒸气使容器压强增大,平衡向逆反应方向移动 | |
| D. | 加入固体碳,平衡向正反应方向移动 |
9.下列反应中,水作为还原剂的是( )
| A. | Cl2+H2O=HCl+HClO | B. | 2Na2O2+2H2O=4NaOH+O2? | ||
| C. | 2F2+2H2O=4HF+O2? | D. | 2Na+4H2O=2NaOH+H2? |
16.用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是( )
| A. | 铜$\stackrel{浓硫酸}{→}$硝酸铜 | B. | 铜$\stackrel{稀硫酸}{→}$硝酸铜 | ||
| C. | Cu$\stackrel{Cl_{2}}{→}$CuCl2$\stackrel{AgNO_{3}}{→}$Cu(NO3)2 | D. | Cu$\stackrel{空气}{→}$CuO$\stackrel{HNO_{3}}{→}$Cu(NO3)2 |
13.将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是( )
| A. | 若V1>V2,则说明HA的酸性比HB的酸性强 | |
| B. | 若V1>V2,则说明HA的酸性比HB的酸性弱 | |
| C. | 因为两种酸溶液的pH相等,故V1一定等于V2 | |
| D. | HA、HB分别和NaOH中和后,所得的溶液都一定呈中性 |