题目内容
8.(1)以下均为中学化学中的常见实验装置,下列有关说法正确的是BCE.
A.装置①,用于分离沸点不同的两种液态有机物
B.装置②,可用于检验碳酸钠与碳酸氢钠两种固体
C.装置③,可用于CO还原氧化铁实验
D.装置④,适用实验室制取少量乙炔
E.装置⑤,选择合适药品时,可用于制备少量氨气及氧气等
(2)欲量取20.00mL Na2CO3溶液,应选用的仪器是碱式滴定管.
(3)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒.
(4)在测定硫酸铜晶体中结晶水含量的实验中,称量操作至少要进行4次.
分析 (1)①为蒸馏装置,可用于分离沸点不同的两种液体;
②为固体加热制取气体装置;
③可用于实验室制取金属,比如氢气还原氧化铜,CO还原氧化铁等;
④碳化钙与水反应生成乙炔,该反应不需要加热;
⑤可用浓氨水、碱石灰制备氨气,用二氧化锰、双氧水制备氧气,此装置无加热装置,据此解答即可;
(2)准确度为0.01mL,应该选用滴定管,碳酸钠溶液显示碱性,故用碱式滴定管;
(3)中和热测定实验中,用到的玻璃仪器有烧杯、温度计、量筒、环形玻璃棒等;
(4)根据测定硫酸铜晶体中结晶水的正确操作方法进行判断.
解答 解:(1)A.装置①用于分离沸点不同的两种液态有机物,温度计需放在蒸馏烧瓶支管口处,故A错误;
B.碳酸钠加热不分解,碳酸氢钠加热分解,此装置可以用来验证此两种物质,故B正确;
C.③装置可用于实验室制取金属,比如氢气还原氧化铜,CO还原氧化铁等,故C正确;
D.制取乙炔时不需要加热,故D错误;
E.通过装置⑤,可用浓氨水、碱石灰制备氨气,用二氧化锰、双氧水制备氧气,故E正确;
故答案为:BCE;
(2)量取20.00mL的碳酸钠溶液,根据准确度可知,选用用滴定管量取,由于碳酸钠溶液呈碱性,则应该用碱式滴定管,
故答案为:碱式滴定管;
(3)中和热测定实验中,反应在烧杯烧杯中进行,温度计用于测量反应的温度,量筒用于量取一定体积的酸、碱溶液,环形玻璃棒用于搅拌,使反应充分进行,
故答案为:环形玻璃搅拌棒、量筒;
(4)在硫酸铜结晶水含量的测定实验中,实验中的加热、冷却、称量的操作步骤要重复进行,直至连续两次称量的差不超过0.1 g为止,一般情况下,结晶水含量测定时称量次数不得少于4次,
故答案为:4.
点评 本题考查了化学实验装置的综合应用,题目难度中等,明确化学实验基本操作方法为解答关键,注意掌握常见化学实验装置的特点及应用方法,试题充分考查了学生的分析能力及化学实验能力.

 阅读快车系列答案
阅读快车系列答案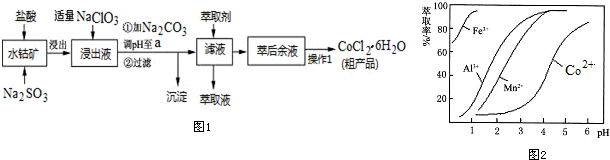
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5.

| A. | 原子半径大小比较为A>B>C>D | B. | 生成的氢化物稳定性为A>B>C>D | ||
| C. | A与C形成的阴离子可能有AC${\;}_{3}^{2-}$ | D. | A、B、C、D的单质常温下均不导电 |

| A. | 图①用于实验室制乙烯 | |
| B. | 图②用于实验室制乙炔并验证乙炔可以发生氧化反应 | |
| C. | 图③用于实验室中分馏石油 | |
| D. | 图④中若A为醋酸,B为贝壳,C为苯酚钠溶液,则可验证醋酸的酸性大于碳酸,但不能验证碳酸的酸性大于苯酚 |

 对叔丁基苯酚(
对叔丁基苯酚(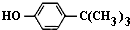 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下: .
.

 分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化:
分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化: .
.