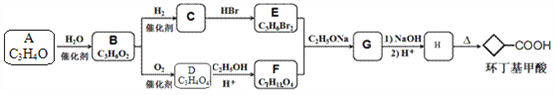
题目内容
【题目】常温下,向lL0.lmol·L-1一元酸HR溶液中逐渐通人氨气[已知常温下Kb(NH3H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如右图所示。下列叙述正确的是( )

A. 0.1 mol·L-1HR溶液的pH约为3
B. HR为弱酸,常温时Ka (HR)=1×l0-7
C. 当通入0.1molNH3时,c(R-)>c(NH4+)
D. 当c(HR) =c(R-)时,溶液必为中性
【答案】A
【解析】A.pH=5时,lg![]() =0,则
=0,则![]() = 1,说明HR在溶液中不能完全电离,HR是弱酸,根据HR
= 1,说明HR在溶液中不能完全电离,HR是弱酸,根据HR![]() H++R-可知,Ka(HR) =
H++R-可知,Ka(HR) = ![]() ,pH=5时,Ka(HR)=c(H+)=10-5mol/L,因溶液温度不变,则Ka始终不变。设0.1 mol·L-1HR溶液中H+的浓度为xmol/L,则Ka =
,pH=5时,Ka(HR)=c(H+)=10-5mol/L,因溶液温度不变,则Ka始终不变。设0.1 mol·L-1HR溶液中H+的浓度为xmol/L,则Ka = ![]() =
=![]() =10-5mol/L,解得x=10-3mol/L,则pH=-lgc(H+)=3,故A正确;B.根据A项分析可知,HR是弱酸,常温时Ka(HR)=10-5mol/L,故B错误;C. lL0.lmol·L-1一元酸HR溶液中n(HR)=0.1mol,当通入0.1molNH3 时,恰好与HR完全反应,得NH4R溶液,因Ka(HR)<Kb(NH3H2O),所以R-的水解程度大于NH4+的水解程度,则c(R-)<c(NH4+),故C错误;D.据图可知,当c(HR) =c(R-)时,lg
=10-5mol/L,解得x=10-3mol/L,则pH=-lgc(H+)=3,故A正确;B.根据A项分析可知,HR是弱酸,常温时Ka(HR)=10-5mol/L,故B错误;C. lL0.lmol·L-1一元酸HR溶液中n(HR)=0.1mol,当通入0.1molNH3 时,恰好与HR完全反应,得NH4R溶液,因Ka(HR)<Kb(NH3H2O),所以R-的水解程度大于NH4+的水解程度,则c(R-)<c(NH4+),故C错误;D.据图可知,当c(HR) =c(R-)时,lg![]() =0,pH=5,溶液成酸性,故D错误;答案选A。
=0,pH=5,溶液成酸性,故D错误;答案选A。

【题目】某化学小组在实验室制取 Na2O2。查阅资料可知:钠与空气在 453473K 之间可生成 Na2O,迅速提高温度到 573673K 之间可生成 Na2O2,若温度提高到 733873K 之间 Na2O2 可分解。
(1)甲组设计制取 Na2O2 装置如图1。
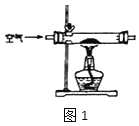
①使用该装置制取的 Na2O2 中可能含有的杂质为_____。.
A.NaCl B.Na2CO3 C.Na2O D.NaOH E.NaHCO3
②该小组为测定制得的 Na2O2 样品的纯度,设计可能用到的装置如图 2:烧瓶中发生的主要反应的化学方程式是_________。测定装置的接口从 左至右正确的连接顺序是_____。

(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果_____ (填“偏大”或“偏 小”)。为证明其分析的正确性,设计实验方案如下:
实验方案 | 产生的现象 |
Ⅰ.取烧瓶中的反应液加入少量 MnO2 粉末 | 有大量气泡逸出 |
Ⅱ.向 NaOH 稀溶液中加入 23 滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色开始无明显现象。 |
Ⅲ.向反应液中加入 23 滴酚酞试液,充分振荡,然后逐滴加入 过量的 NaOH 稀溶液 | 加 NaOH 溶液先 变红后褪色 |
在上述实验中,能够证明乙组分析正确的最佳方案是_________ (填实验序号)。_______________组实验得不出结论,原因是_____。
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度。请简述实验操作和需 要测定的有关数据__________________________________
【题目】除去下列物质中少量杂质所需除杂试剂及方法不正确的是( )
物质(杂质) | 除杂试剂 | 除杂方法 | |
A | 乙醇(水) | CaO | 蒸馏 |
B | 淀粉溶液(NaCl) | ——— | 渗析 |
C | CO2(HCl) | NaOH溶液 | 洗气 |
D | NaCl溶液(I2) | CCl4 | 萃取分液 |
A.A
B.B
C.C
D.D