题目内容
【题目】某化学小组在实验室制取 Na2O2。查阅资料可知:钠与空气在 453473K 之间可生成 Na2O,迅速提高温度到 573673K 之间可生成 Na2O2,若温度提高到 733873K 之间 Na2O2 可分解。
(1)甲组设计制取 Na2O2 装置如图1。
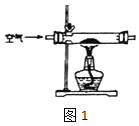
①使用该装置制取的 Na2O2 中可能含有的杂质为_____。.
A.NaCl B.Na2CO3 C.Na2O D.NaOH E.NaHCO3
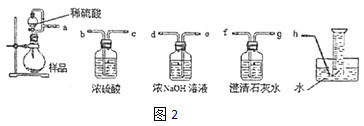
②该小组为测定制得的 Na2O2 样品的纯度,设计可能用到的装置如图 2:烧瓶中发生的主要反应的化学方程式是_________。测定装置的接口从 左至右正确的连接顺序是_____。
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果_____ (填“偏大”或“偏 小”)。为证明其分析的正确性,设计实验方案如下:
实验方案 | 产生的现象 |
Ⅰ.取烧瓶中的反应液加入少量 MnO2 粉末 | 有大量气泡逸出 |
Ⅱ.向 NaOH 稀溶液中加入 23 滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色开始无明显现象。 |
Ⅲ.向反应液中加入 23 滴酚酞试液,充分振荡,然后逐滴加入 过量的 NaOH 稀溶液 | 加 NaOH 溶液先 变红后褪色 |
在上述实验中,能够证明乙组分析正确的最佳方案是_________ (填实验序号)。_______________组实验得不出结论,原因是_____。
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度。请简述实验操作和需 要测定的有关数据__________________________________
【答案】BCD 2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O aedfgh 偏小 I II II 中有硫酸存在,所以溶液褪色的原因不一定是被漂白 称取一定质量的样品(m),加热 733873K 使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算
【解析】
(1)①钠与氧气反应可以得到氧化钠、过氧化钠,二者均与二氧化碳反应得到碳酸钠,与水反应会得到氢氧化钠,而碳酸氢钠受热分解;
②烧瓶中过氧化钠与硫酸反应生成硫酸钠、氧气与水;用浓氢氧化钠溶液吸收可能氧气中混有二氧化碳,澄清石灰水检验二氧化碳是否除尽,用排水法收集氧气,根据氧气体积可以计算过氧化钠的质量,进而计算样品中过氧化钠的质量分数;
(2)实验I说明中间产物为过氧化氢,且过氧化氢没有完全分解为氧气,导致测定氧气体积偏小;
实验Ⅱ:反应后的溶液中有硫酸剩余,可以使红色酚酞溶液褪色;
实验Ⅲ:加入的氢氧化钠先中和剩余的硫酸,过量的氢氧化钠式溶液显红色,过氧化氢具有强氧化性,又使溶液红色褪去;
(3)称取一定质量的样品(m),加热733873使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算,或者称取一定质量的样品(m),进入少量二氧化锰,再加入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算。
(1)①钠与氧气反应可以得到氧化钠、过氧化钠,二者均与二氧化碳反应得到碳酸钠,与水反应会得到氢氧化钠,由信息可以知道钠与氮气不反应,而碳酸氢钠受热分解,Na2O2 中可能含有的杂质为Na2CO3、Na2O、NaOH,
因此,本题正确答案是:BCD;
②烧瓶中过氧化钠与硫酸反应生成硫酸钠、氧气与水,反应方程式为:2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O ,
用浓氢氧化钠溶液吸收可能氧气中混有二氧化碳,澄清石灰水检验二氧化碳是否除尽,用排水法收集氧气,根据氧气体积可以计算过氧化钠的质量,进而计算样品中过氧化钠的质量分数,测定装置的接口从左至右正确的连接顺序是aedfgh,
因此,本题正确答案是:2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O;aedfgh;
(2) 实验I说明中间产物为过氧化氢,且过氧化氢没有完全分解为氧气,导致测定氧气体积偏小,所以能够证明乙组分析正确的最佳方案是实验I;
实验Ⅱ:反应后的溶液中有硫酸剩余,可以使红色酚酞溶液褪色,所以溶液褪色的原因不一定是被漂白;
实验Ⅲ:加入的氢氧化钠先中和剩余的硫酸,过量的氢氧化钠式溶液显红色,过氧化氢具有强氧化性,又使溶液红色褪去,反应溶液中存在的中间产物与酚酞作用的条件是碱性条件,
因此,本题正确答案是:偏小;I;II ;I 中有硫酸存在,所以溶液褪色的原因不一定是被漂白;
(3) 称取一定质量的样品(m),加热733873使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算,或者称取一定质量的样品(m),进入少量二氧化锰,再加入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算,
因此,本题正确答案是:称取一定质量的样品(m),加热 733873K 使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算。

【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
B | 淀粉水解后的溶液加入新制Cu(OH)2浊液,再加热 | 无砖红色沉淀 | 淀粉水解产物不含醛基 |
C | 用铂丝蘸取少量溶液进行焰色反应 | 火焰呈黄色 | 该溶液是钠盐溶液 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1 nol/L的NaI溶液,再振荡, | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D