题目内容
【题目】为了保护环境,充分利用资源,可将工业废弃物转变成重要的化工原料。
请回答下列问题:
(1)可用NaClO3氧化酸性FeCl2废液得到FeCl3,FeCl3具有净水作用,但腐蚀设备。
①写出NaClO3氧化酸性FeCl2的离子方程式:__________________________。
②若酸性FeCl2废液中:c(Fe2+)=2.0×10-2 mol∕L,c(Fe3+)=1.0×10-3 mol∕L,c(Cl-)=5.3×10-2 mol∕L,则该溶液的pH约为_________。
③FeCl3净水的原理是:_________________(用离子方程式及适当文字回答);FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是_________(用离子方程式表示)。
(2)可用废铁屑为原料,按下图的工艺流程制备聚合硫酸铁(PFS),PFS是一种新型的
絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
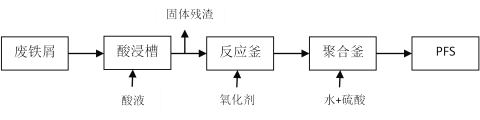
①酸浸时最合适的酸是______________。
②反应釜中加入的氧化剂,下列试剂中最合适的是____________(填标号)。
a.HNO3 b.KMnO4 c.Cl2 d.H2O2
检验其中Fe2+是否完全被氧化,应选择____________________(填标号)。
a.K3[Fe(CN)6]溶液 b.Na2SO3溶液 c.KSCN溶液
③生成PFS的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+欲使平衡正向移动可采用的方法是____________(填标号)。
a.加入NaHCO3 b.降温 c.加水稀释 d.加入NH4Cl
(3)废铁屑在一定条件下,可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,维持电流强度为1A,a电池工作1小时,理论上消耗FeS2__________g。(已知1mol电子的电量为96500C)
【答案】 ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O 2 Fe3++3H2O![]() 3H++Fe(OH)3,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质 2Fe3++Fe=3Fe2+ 硫酸 d a ac 1.1g
3H++Fe(OH)3,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质 2Fe3++Fe=3Fe2+ 硫酸 d a ac 1.1g
【解析】(1)本题考查氧化反应方程式的配平、pH的计算、盐类水解等知识,①利用ClO3-的强氧化性,把Fe2+氧化成Fe3+,本身被还原成Cl-,利用化合价的升降法进行配平,即ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O ;②根据电荷守恒,2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-),代入数值,2×2×10-2+3×10-3+c(H+)=5.3×10-2,解得c(H+)=1×10-2mol·L-1,因此pH=2;③FeCl3净水,利用Fe3+的水解:Fe3++3H2O ![]() Fe(OH)3+3H+,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;钢铁成分是Fe,与FeCl3发生:Fe+2Fe3+=3Fe2+;(2)考查化学工艺流程,①流程制备的是聚合硫酸铁,为了不引入新杂质,因此最适合的酸是硫酸;②a、容易引入NO3-,故a错误;b、KMnO4作氧化剂,被还原成Mn2+,引入新杂质,故b错误;c、使用氯气,引入Cl-,故c错误;d、H2O2作氧化剂,被还原成H2O,不引入杂质,故d正确;检验Fe2+是否完全被氧化,需要检验Fe2+是否存在,需要用K3[Fe(CN)6] 溶液,进行检验,如果出现蓝色沉淀,说明Fe2+没有被完全氧化,故a正确;③a、加入NaHCO3,HCO3-消耗H+,减少生成物的浓度,平衡向正反应方向进行,故a正确;b、此反应属于盐类水解,盐类水解是吸热反应,降温,平衡向逆反应方向进行,故b错误;c、加水稀释,离子浓度降低,平衡向正反应方向进行,故c正确;d、加入NH4Cl,对此平衡的移动不产生影响,故d错误;(3)本题考查电化学的计算,根据电池总反应,正极反应式为FeS2+4e-=Fe+2S2-,维持电流强度为1A,电池工作1小时,因此转移电子的物质的量为3600/36500mol,因此消耗的FeS2的质量为120×3600/(4×96500)g=1.1g。
Fe(OH)3+3H+,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;钢铁成分是Fe,与FeCl3发生:Fe+2Fe3+=3Fe2+;(2)考查化学工艺流程,①流程制备的是聚合硫酸铁,为了不引入新杂质,因此最适合的酸是硫酸;②a、容易引入NO3-,故a错误;b、KMnO4作氧化剂,被还原成Mn2+,引入新杂质,故b错误;c、使用氯气,引入Cl-,故c错误;d、H2O2作氧化剂,被还原成H2O,不引入杂质,故d正确;检验Fe2+是否完全被氧化,需要检验Fe2+是否存在,需要用K3[Fe(CN)6] 溶液,进行检验,如果出现蓝色沉淀,说明Fe2+没有被完全氧化,故a正确;③a、加入NaHCO3,HCO3-消耗H+,减少生成物的浓度,平衡向正反应方向进行,故a正确;b、此反应属于盐类水解,盐类水解是吸热反应,降温,平衡向逆反应方向进行,故b错误;c、加水稀释,离子浓度降低,平衡向正反应方向进行,故c正确;d、加入NH4Cl,对此平衡的移动不产生影响,故d错误;(3)本题考查电化学的计算,根据电池总反应,正极反应式为FeS2+4e-=Fe+2S2-,维持电流强度为1A,电池工作1小时,因此转移电子的物质的量为3600/36500mol,因此消耗的FeS2的质量为120×3600/(4×96500)g=1.1g。