题目内容
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_______________________,其基态原子的价层电子排布图为__________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_________(填标号)。

(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是___________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为______。
(5)某R的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为ρg/cm3,距离最近的两个原子的距离为d pm,则R的相对原子质量为___________________。 (阿伏加德罗常数为NA)

(6)X形成的一种常见单质,性质硬而脆,原因是____________________。
【答案】 第四周期,ⅣA族 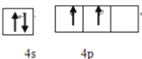 b sp、sp2 25:1 三角锥形 GeO (
b sp、sp2 25:1 三角锥形 GeO (![]() )3×ρ×
)3×ρ×![]() ×NA-16 碳碳键键能大,故硬;但共价键有方向性,受大的外力时,会发生原子错位而断裂,故脆
×NA-16 碳碳键键能大,故硬;但共价键有方向性,受大的外力时,会发生原子错位而断裂,故脆
【解析】X原子有3个能级,且每个能级上的电子数相等,电子排布式为1s22s22p2,推出X为C,因为X、Y、R三元素在周期表同族,因此Y为Si,R为Ge,原子序数依次增大,Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低,因此Z为P,(1)Ge位于第四周期第IVA族,因为是主族元素,因此价电子是最外层电子,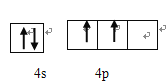 ;(2)本题考查电离能的规律,同主族从上到下第一电离能减小,P元素3p能级为半满稳定状态,第一电离能高于同周期相邻元素,故Si的第一电离能最小,P原子第四电离能为失去4s2能中的1个电子,为全满稳定状态,与第三电离能相差较大,因此b曲线为P;(3)本题考查杂化类型、化学键的判断,CH2=C=O中“CH2=”中的碳原子有3个σ键,无孤电子对,因此杂化类型为sp2,“C=O”中的C有2个σ键,无孤电子对,杂化类型为sp;成键电子对之间只能形成一个σ键,双键中有一个π键,因此σ键和π键的数目比值为25:1;(4)本题考查空间构型,P和氯气反应生成PCl3和PCl5,均满足8电子结构的是PCl3,中心原子是P,有3个σ键,孤电子对数为(5-3)/2=1,因此空间构型为三角锥形;(5)本题考查晶胞的结构,氧原子位于顶点和面心,个数为8×1/8+6×1/2=4,Ge全部位于晶胞内部,因此化学式为GeO,晶胞的质量为4×(M+16)/NAg,距离最近的两个原子是体对角线的1/4,因此体对角线为4d,则边长为
;(2)本题考查电离能的规律,同主族从上到下第一电离能减小,P元素3p能级为半满稳定状态,第一电离能高于同周期相邻元素,故Si的第一电离能最小,P原子第四电离能为失去4s2能中的1个电子,为全满稳定状态,与第三电离能相差较大,因此b曲线为P;(3)本题考查杂化类型、化学键的判断,CH2=C=O中“CH2=”中的碳原子有3个σ键,无孤电子对,因此杂化类型为sp2,“C=O”中的C有2个σ键,无孤电子对,杂化类型为sp;成键电子对之间只能形成一个σ键,双键中有一个π键,因此σ键和π键的数目比值为25:1;(4)本题考查空间构型,P和氯气反应生成PCl3和PCl5,均满足8电子结构的是PCl3,中心原子是P,有3个σ键,孤电子对数为(5-3)/2=1,因此空间构型为三角锥形;(5)本题考查晶胞的结构,氧原子位于顶点和面心,个数为8×1/8+6×1/2=4,Ge全部位于晶胞内部,因此化学式为GeO,晶胞的质量为4×(M+16)/NAg,距离最近的两个原子是体对角线的1/4,因此体对角线为4d,则边长为![]() pm,晶胞的体积为(
pm,晶胞的体积为(![]() ×10-10)3,根据晶胞的密度,求出M,则M=(
×10-10)3,根据晶胞的密度,求出M,则M=(![]() )3×ρ×
)3×ρ×![]() ×NA-16;(6)碳碳键键能大,故硬;但共价键有方向性,受大的外力时,会发生原子错位而断裂,故脆。
×NA-16;(6)碳碳键键能大,故硬;但共价键有方向性,受大的外力时,会发生原子错位而断裂,故脆。

【题目】工业生产中常将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金。这是制取合金的常用方法之一。根据下表数据判断,不宜用上述方法制取合金的是( )
金属 | Na | Al | Cu | Fe |
熔点(℃) | 97.81 | 660 | 1 083 | 1 535 |
沸点(℃) | 883 | 2 200 | 2 595 | 3 000 |
A. Fe-Cu合金 B. Cu-Al合金 C. Al-Na合金 D. Cu-Na合金