题目内容
20.已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/molC3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220kJ/mol
7molH2与C3H8混合物完全燃烧,共放热5869kJ,则二者的体积比V(H2):V(C3H8)为( )
| A. | 1:1 | B. | 2:5 | C. | 3:4 | D. | 5:2 |
分析 化学反应的燃烧热和物质的量之间成正比,设H2的物质的量为nmol,则C3H8的物质的量为(7-n)mol,根据放出的热量列方程式求解,相同条件下气体的体积比等于物质的量比,据此分析解答.
解答 解:设混合气中H2的物质的量为nmol,则C3H8的物质的量为(7-n)mol,根据题意,列方程为nmol×$\frac{571.6KJ/mol}{2}$+(7-n)mol×2220kJ/mol=5869KJ,解得n=5mol,7molH2与C3H8混合物中两者的物质的量比为5:2,相同条件下气体的体积比等于物质的量比,则二者的体积比V(H2):V(C3H8)=5:2,
故选D.
点评 本题考查反应热的有关计算,题目难度不大,关键是注意反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+ (对苯醌)═N2H4+
(对苯醌)═N2H4+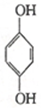 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为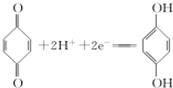 .
.
(2)25℃时,将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①若混合溶液中c(NH4+)=c(Cl-),则溶液的pH=7.
②若混合溶液中c(NH4+)>c(Cl-),则反应的情况可能为a.
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
①写出该反应的化学平衡常数的表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,b小于(填“大于”“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)小于(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+
 (对苯醌)═N2H4+
(对苯醌)═N2H4+ (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为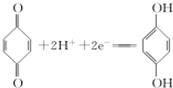 .
.(2)25℃时,将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①若混合溶液中c(NH4+)=c(Cl-),则溶液的pH=7.
②若混合溶液中c(NH4+)>c(Cl-),则反应的情况可能为a.
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)小于(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
11.如图图象与对应的叙述相符的是( )

| A. | 图I表示盐酸滴加到0.1mol/L某碱溶液中得到的滴定曲线,由图I可知二者恰好中和时,所得溶液的pH=7 | |
| B. | 图II表示一定条件下进行的反应2SO2+O2?2SO3△H<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 | |
| C. | 图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20ml Ba(OH)2溶液时,沉淀是Al(OH)3与BaSO4的混合物 | |
| D. | 图IV表示向一定体积含等浓度NH4Cl、AlCl3、MgCl2混合溶液中逐渐加入NaOH溶液至过量的过程中,生成沉淀的质量与加入NaOH溶液的体积之间的关系 |
8.将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品.
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号).
①用混凝法获取淡水
②提高部分产品的质量
③优化提取产品的品种
④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收.已知该反应不产生CO2,且溴歧化为Br-和BrO3-,则反应的离子反应方程式为3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3-.
(3)海水提镁的一段工艺流程如图:
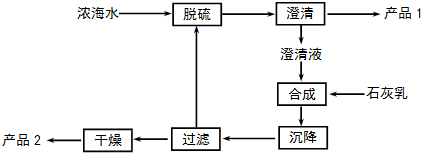
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的阳离子Ca2+,沉降阶段反应的离子方程式为Mg2+(aq)+Ca(OH)2(s)=Mg(OH)2(s)+Ca2+(aq),浓海水的利用率为90%,则1L浓海水最多可得到产品2的质量为62.64g.
(4)由MgCl2•6H2O制备MgCl2固体时是在氯化氢气体氛围中加热进行,其目的是抑制MgCl2水解.
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号).
①用混凝法获取淡水
②提高部分产品的质量
③优化提取产品的品种
④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收.已知该反应不产生CO2,且溴歧化为Br-和BrO3-,则反应的离子反应方程式为3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3-.
(3)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(4)由MgCl2•6H2O制备MgCl2固体时是在氯化氢气体氛围中加热进行,其目的是抑制MgCl2水解.
15.某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的HCO3-、CO32-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

| A. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| B. | V1:V2=l:5 | |
| C. | M点时生成的CO2为0.05mol | |
| D. | e曲线表示的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
5.某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.

设计方案如图1,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(1)查阅资料:
①氮气不与炭粉、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热制得氮气.写出该反应的离子方程式:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O.
②使上述制得的气体通过B装置方能获得干燥的N2
(2)实验步骤:
①按图2连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.步骤②、④中都分别通入N2,其作用分别为步骤②通入氮气的目的是排除装置中的O2;步骤④通入氮气的目的是将生成的CO2全部通入澄清的石灰水中.
(3)数据处理:
①试根据实验数据分析,该反应的气体产物是CO2和CO,理由是过量炭粉与二氧化碳气体反应生成CO气体
②写出该实验中氧化铁与炭粉发生反应的化学方程式:2C+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+CO↑+CO2↑.
(4)实验优化:学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是将澄清的石灰水换成Ba(OH)2溶解度大,浓度大,使CO2被吸收更完全;碳酸钡的相对原子质量大于碳酸钙的,称量时相对误差小.
②pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.现向0.2mol/LBa(OH)2溶液中通入CO2气体,沉淀开始产生时,溶液中CO32-的PC值为7.6(已知:lg2=0.2;Ksp(BaCO3)=5.0x10-9)
③从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:在尾气出口处加一点燃的酒精灯.

设计方案如图1,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
①氮气不与炭粉、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热制得氮气.写出该反应的离子方程式:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O.
②使上述制得的气体通过B装置方能获得干燥的N2
(2)实验步骤:
①按图2连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.步骤②、④中都分别通入N2,其作用分别为步骤②通入氮气的目的是排除装置中的O2;步骤④通入氮气的目的是将生成的CO2全部通入澄清的石灰水中.
(3)数据处理:
①试根据实验数据分析,该反应的气体产物是CO2和CO,理由是过量炭粉与二氧化碳气体反应生成CO气体
②写出该实验中氧化铁与炭粉发生反应的化学方程式:2C+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+CO↑+CO2↑.
(4)实验优化:学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是将澄清的石灰水换成Ba(OH)2溶解度大,浓度大,使CO2被吸收更完全;碳酸钡的相对原子质量大于碳酸钙的,称量时相对误差小.
②pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.现向0.2mol/LBa(OH)2溶液中通入CO2气体,沉淀开始产生时,溶液中CO32-的PC值为7.6(已知:lg2=0.2;Ksp(BaCO3)=5.0x10-9)
③从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:在尾气出口处加一点燃的酒精灯.
12.下列判断正确的是( )
| A. | HClO4、H2SO4、CH3COOH、H2CO3酸性依次减弱 | |
| B. | Cl-、Na+、Mg2+、F-的半径依次减小 | |
| C. | Na、Mg、Al失电子能力随最外层电子的增加而增强 | |
| D. | HI、HBr、HCl、HF的沸点依次降低 |
10.下列反应中,反应后固体质量一定减少的是( )
| A. | 铝与V2O5发生铝热反应 | B. | 镁粉投入到FeCl3溶液中 | ||
| C. | 碳粉与CuO混合物在试管中加热 | D. | 水蒸气通入足量Na2O2粉末 |
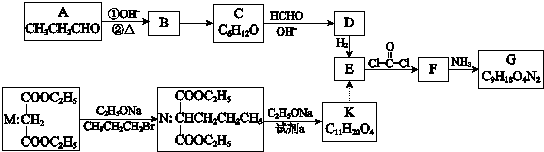
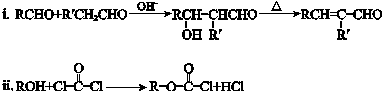
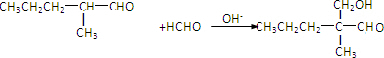 .
. .
.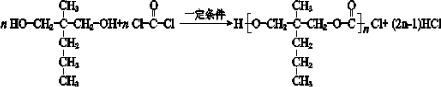 .
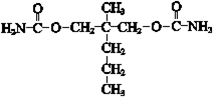
.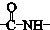 ”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是
”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是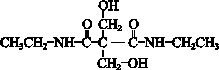 .
.