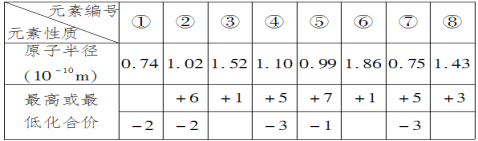
题目内容
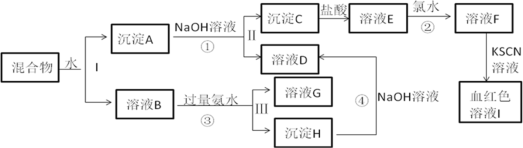
【题目】如图所示,下列说法正确的是( )
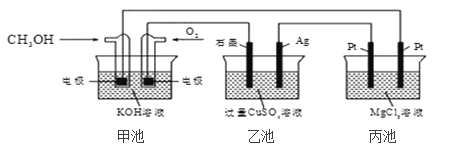
A. 若将乙池电解液换成 AgNO3 溶液,则可以实现在石墨棒上镀银
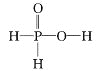
B. 甲池通入 CH3OH 的电极反应式为 CH3OH+6e+2H2O═CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4 溶液恢复到原浓度
D. 甲池中消耗 224mL(标准状况下)O2,此时丙池中理论上产生 1.16g 固体
【答案】D
【解析】
根据图示,甲池为原电池,通入甲醇的为负极,则乙池中银电极和丙池中右边的铂电极为阴极;通入氧气的为正极,则乙池中石墨电极和丙池中左边的铂电极为阳极,据此分析解答。
A.乙池中石墨连接甲池的正极,为电解池的阳极,银电极为阴极,若将乙池电解液换成 AgNO3 溶液,阳极上溶液中的氢氧根离子放电生成氧气,不能实现在石墨棒上镀银,故A错误;
B.在燃料电池中,负极是甲醇发生失电子的氧化反应,在碱性电解质下的电极反应为CH3OH-6e-+2H2O+8OH-=CO32-+8H2O,故B错误;
C.电解池乙池中,电解后生成硫酸、铜和氧气,要想复原,要加入氧化铜,不能加入氢氧化铜,故C错误;
D.甲池中消耗224mL(标准状况下)O2,即![]() =0.01mol,转移电子0.04mol,根据转移的电子守恒,丙池中生成0.02mol氢气,同时生成0.04mol氢氧根离子,氢氧根离子和镁离子生成氢氧化镁沉淀,所以氢氧化镁沉淀的物质的量是0.02mol,氢氧化镁沉淀的质量=0.02mol×58g/mol=1.16g,故D正确;
=0.01mol,转移电子0.04mol,根据转移的电子守恒,丙池中生成0.02mol氢气,同时生成0.04mol氢氧根离子,氢氧根离子和镁离子生成氢氧化镁沉淀,所以氢氧化镁沉淀的物质的量是0.02mol,氢氧化镁沉淀的质量=0.02mol×58g/mol=1.16g,故D正确;
答案选D。

练习册系列答案
相关题目