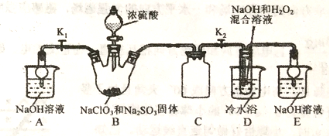
题目内容
【题目】将一小块钠投入到FeCl3溶液中,观察到的现象是( )
A. 钠溶解,有铁析出并有气体产生
B. 只有气体产生
C. 既有气体产生,又有红褐色沉淀产生
D. 只有沉淀产生
【答案】C
【解析】
钠投入到FeCl3溶液中,先与水反应生成NaOH和H2,接着NaOH与FeCl3反应生成NaCl和Fe(OH)3沉淀,故选C。

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入体积不变的容器内各组分的物质的量见下表:
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入体积不变的容器内各组分的物质的量见下表:
CO2 | H2 | CO | H2O | |
甲 | 2a mol | 2a mol | 0 | 0 |
乙 | 2a mol | a mol | 0 | 0 |
丙 | 0 | 0 | 2a mol | 2a mol |
丁 | amol | 0 | a mol | a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙>丁>甲>丙 B. 乙=丁<丙=甲
C. 丁>乙>丙=甲 D. 丁>丙>乙>甲