题目内容
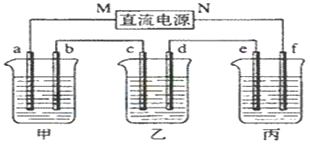
【题目】下列各变化中属于原电池反应的( )
A. 在空气中金属铝表面迅速氧化形成保护层
B. 锌与稀硫酸反应时,用锌粉代替锌块可使反应加快
C. 红热的铁丝与冷水接触,表面形成蓝黑色保护层
D. 镀锌铁表面有划损时,仍然能阻止铁被氧化
【答案】D
【解析】A.铝和空气中氧气反应生成氧化铝,属于化学腐蚀,不属于原电池反应,故A错误;B.锌与稀硫酸反应时,用锌粉代替锌块,使得接触面积增大,反应加快,不属于原电池反应,故B错误;C.铁和水蒸气反应生成四氧化三铁,属于化学腐蚀,不属于原电池反应,故C错误;D.镀锌铁表面有划损时,锌比铁活泼是负极,构成原电池,铁是正极,不被腐蚀,属于原电池反应,故D正确;故选D。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】以天然气代替石油生产液体燃料和基础化学品是当前化学研究和发展的重点。
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%。已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种。
①有关化学键键能数据如表中所示:
化学键 | H-H | C=C | C-C | C≡C | C-H |
E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
写出甲烷一步生成乙烯的热化学方程式_________________________,反应中硅化物晶格限域的单中心铁催化剂的作用是________________________;
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为___________;
③生成1 mol Z产生的H2约合标准状况下________L。
(2)如图为乙烯气相直接水合法制备乙醇中乙烯的平衡转化率与温度、压强的关系
(其中n(H2O):n(C2H4)=1:1)。

①若p2=8.0 MPa,列式计算A点的平衡常数Kp=____________(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位);
②该反应为__________(填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为____________,理由是________________;
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9 MPa,n(H2O):n(C2H4)=0.6:1。乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有______________(任写两条)。
(3)乙烯可以作为燃料电池的负极燃料,请写出以熔融碳酸盐作为电解质时,负极的电极反应式________________________________。
【题目】据报道:研究人员破解了北京及华北地区雾霾主要成分硫酸盐的形成之谜,发现在大气细颗粒物吸附的水分中NO2与SO2的化学反应是当前雾霾期间硫酸盐的主要生成路径。某实验小组对NO2和SO2的反应进行探究。
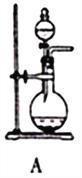

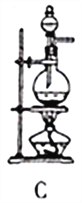
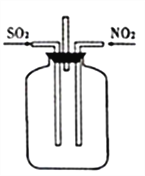
图Ⅰ 图Ⅱ
(1)SO2的发生装置可以选择图Ⅰ中的_______(填字母),反应的化学方程式为___________________。
(2)按图Ⅱ所示进行实验。
①实验时往集气瓶中通入等体积的SO2和NO2,观察到集气瓶中有白烟产生,通入的NO2气体颜色变浅,该反应的化学方程式为______________________。如果集气瓶中有少量水,则可能观察不到白烟,其原因是____________。
②请指出图Ⅱ装置设计的不合理之处___________。
(3)硫酸铵是我国pm2.5雾霾的主要成分,收集一定量的雾霾固体进行验证:
操作步骤 | 实验现象 | 结论 |
取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份。 | ||
一份___________。 | 有白色沉淀生成。 | 证明雾霾固体中含有SO42- |
另一份___________。 | ___________。 | 证明雾霾固体中含有NH4+。综合上面实验,说明雾霾固体颗粒中含有(NH4)2SO4。 |