题目内容
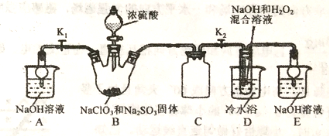
【题目】亚氯酸钠是重要漂白剂,大庆市某高中化学实验探究小组设计如下实验制备亚氯酸钠(NaClO2)晶体。
【查阅资料】
I.NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成 NaClO3和NaCl。
II.B中发生的主要反应:2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O。
【进行实验】
(1)盛装NaClO3和Na2SO3固体的仪器名称是_____。
(2)装置C的作用是____________。
(3)ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______。
(4)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作。
①55℃蒸发结晶;②趁热过滤;③38-60℃热水洗涤;④低于____干燥,得到成品。
右图是某同学的过滤操作示意图,其操作不规范的是________(填标号)。
a.将滤纸湿润,使其紧贴漏斗壁
b.滤纸边缘高出漏斗边缘
c.用玻璃棒引流
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
【实验反思】
(1)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______。
(2)实验须使B中NaClO3稍微过量,原因是__________,如NaClO3不足,则装置D中可能产生SO42-,检验装置D中是否含有SO42-的方法是:取少量D中反应后的溶液于试管中,__________,证明溶液中存在SO42-。
(3)测定产品中NaClO2的纯度。测定时进行如下实验:
准确称mg样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用cmol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。所称取的样品中NaClO2<span lang="EN-US" style="font-size:10.5pt;mso-bidi-font-size:12.0pt;font-family:"Times New Roman","serif";mso-fareast-font-family:"Times New Roman";mso-ansi-language:EN-US;mso-fareast-language:ZH-CN;mso-bidi-language:AR-SA">质量百分含量</span>为_________(用含m、c、V的代数式表示)。
【答案】 三颈烧瓶 防止D试管中液体进入B中(或安全瓶、防倒吸) 2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O 60℃ b d NaClO3和NaCl NaClO3稍微过量,防止B中产生SO2进入D试管中,影响产品纯度 加入足量的盐酸,无现象,再加适量BaCl2溶液,产生白色沉淀 ![]() %
%
【解析】本题考查实验方案设计与评价,【进行实验】(1)盛放NaClO3和Na2SO3的固体的仪器是三颈烧瓶;(2)装置C的作用是安全瓶,防止D试管中液体进入装置B中;(3)根据信息,ClO2→NaClO2,其中Cl的化合价由+4价→+3价,化合价降低,即ClO2作氧化剂,H2O2作还原剂,被氧化成O2,因此有ClO2+H2O2+NaOH→NaClO2+O2↑+H2O,然后根据化合价的升降发进行配平,即离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O ;(4)根据信息,NaClO2在高于60℃时,分解成NaClO3和NaCl,因此低于60℃干燥;过滤注意事项:一贴二低三靠,a、根据过滤时注意事项,故a说法正确;b、过滤时滤纸的边缘低于漏斗边缘,故b说法错误;c、过滤时用玻璃棒引流,故c说法正确;d、过滤时不能用玻璃棒搅拌,防止弄破滤纸,故d说法正确;【实验反思】(1)如果撤去D中冷水浴,可能造成温度超过60℃,使NaClO2分解成NaClO3和NaCl,因此产品中杂质可能是NaClO3和NaCl;(2)因为硫酸和亚硫酸钠反应生成SO2,SO2进入装置D中,产生杂质,因此NaClO3稍微过量的目的是防止B中产生SO2进入D试管中,影响产品纯度;检验SO42-的操作是:加入足量的盐酸,无现象,再加适量BaCl2溶液,产生白色沉淀;(3)建立关系式:ClO2-~2I2~4S2O32-,因此样品中m(NaClO2)=V×10-3×c×100×90.5/(4×25)g,即质量分数为V×10-3×c×100×90.5/(4×25×m)×100%=![]() %。
%。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 验证Fe(NO3)2是否变质 | 将Fe(NO3)2溶于稀硫酸中,再滴加KSCN溶液,观察是否变化 |
B | 制备Fe(OH)3胶体 | 向沸水中滴加饱和FeCl3溶液,加热并搅拌 |
C | 证明氧化性H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
D | 验Ksp(AgI)<Ksp(AgCl) | 向AgCl的悬浊液中滴加KI溶液,出现黄色沉淀 |
A. A B. B C. C D. D




