题目内容
18.在氨水中存在电离平衡:NH3•H20?NH4++OH-,下列说法错误的是( )| A. | 向氨水中通入HCl气体,溶液导电性增强 | |
| B. | 向氨水中加入水,$\frac{{C}_{(O{H}^{-})}}{N{H}_{3}•{H}_{2}O}$值增大 | |
| C. | 向氨水中通入NH3,电离度增大 | |
| D. | 向氨水中加入水,Kb不变 |
分析 A、向氨水中通入HCl气体,电离平衡:NH3•H20?NH4++OH-,正向移动,溶液中自由移动离子浓度增多;
B、向氨水中加入水,促进一水合氨的电离,氢氧根离子的物质的量增大,而一水合氨的物质的量减少,由此分析解答;
C、浓度越稀电离度越大,浓度越大电离度越小;
D、Kb温度的常数,温度不变,Kb不变.
解答 解:A、向氨水中通入HCl气体,促使电离平衡:NH3•H20?NH4++OH-正向移动,溶液中自由移动铵根离子和氯离子的浓度都增大,所以导电能力增强,故A正确;
B、向氨水中加入水,促进一水合氨的电离,氢氧根离子的物质的量增大,而一水合氨的物质的量减少,所以$\frac{n(O{H}^{-})}{n(N{H}_{3}•{H}_{2}O)}$增大,分子和分母都除以溶液的体积,分式的值不变,则$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$值增大,故B正确;
C、浓度越稀电离度越大,浓度越大电离度越小,所以向氨水中通入NH3,电离度减小,故C错误;
D、Kb温度的常数,温度不变,Kb不变,故D正确;
故选C.
点评 本题影响弱电解质电离因素,明确改变条件时哪些微粒改变引起平衡移动是解本题关键,题目难度不大.

练习册系列答案
相关题目
9.下列反应的离子方程式书写正确的是( )
| A. | 过量铁加入到稀硝酸中:3Fe+8H++2NO3-═3Fe2++2NO2↑+4H2O | |
| B. | 向AgCl悬浊液中滴加饱和KI溶液 AgCl+I-═AgI+Cl- | |
| C. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+H2O═2Al(OH)3↓+HCO3- | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
3.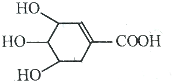 八角茴香含有一种抗亚洲禽流感病毒的重要成分--莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
八角茴香含有一种抗亚洲禽流感病毒的重要成分--莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
 八角茴香含有一种抗亚洲禽流感病毒的重要成分--莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
八角茴香含有一种抗亚洲禽流感病毒的重要成分--莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )| A. | 可以通过加成反应或取代反应生成含有卤原子的产物 | |
| B. | 含有7种氢原子 | |
| C. | 1mol莽草酸与足量金属钠反应可以得到2mol氢气 | |
| D. | 能发生酯化反应,也能发生消去反应 |

 或
或 .
. .
.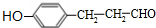 等.
等.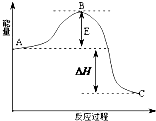 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题: