题目内容
6.下表是元素周期表的一部分,其中所列字母分别代表某一元素.
请你根据表中所给元素,回答下列问题:
(1)最外层上未成对电子数最多的元素是N(填元素符号).
(2)f单质及Fe单质的融合物所属晶体类型是金属晶体.
(3)原子核p亚层有两个空轨道的元素为铝(填写元素名称),该元素最高价氧化物及最高价氧化物的水化物的化学性质相似,可以从两方面去把握,即:既能与强酸溶液反应,又能与强碱溶液反应;写出工业上利用该氧化物制取单质的化学方程式2A12O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4A1+3O2↑;写出往该元素氯化物中滴加足量浓氨水的离子方程式A13++3NH3•H2O═Al(OH)3↓+3NH4+.
(4)单质在空气中燃烧,产生两种粉末状固体化合物的元素是Mg(填元素符号).
(5)用来组成酸、碱、盐三类物质至少需要的元素有acd(填写表中字母).
分析 由元素周期表中元素的位置,可知a是H,b是He,c是N,d是O,e是Mg,f是Al,g是S,h是Cl.
(1)短周期中VA族元素p能级容纳3个电子,未成对电子数最多;
(2)Al单质及Fe单质的融合物属于金属晶体;
(3)原子核p亚层有两个空轨道,核外电子排布为ns2np1,处于ⅢA族,为表中Al元素,该元素最高价氧化物及最高价氧化物的水化物既能与强酸溶液反应,又能与强碱溶液反应;工业上电解熔融氧化铝冶炼铝;氯化铝与氨水反应生成氢氧化铝沉淀与氯化铵;
(4)Mg在空气中燃烧会生成氧化镁、氮化镁;
(5)H、N、O三种元素可以组成酸、碱、盐三类物质.
解答 解:由元素周期表中元素的位置,可知a是H,b是He,c是N,d是O,e是Mg,f是Al,g是S,h是Cl.
(1)短周期中VA族元素p能级容纳3个电子,未成对电子数最多,为表中N元素,故答案为:N;
(2)Al单质及Fe单质的融合物属于金属晶体,故答案为:金属晶体;
(3)原子核p亚层有两个空轨道,核外电子排布为ns2np1,处于ⅢA族,为表中Al元素,该元素最高价氧化物及最高价氧化物的水化物既能与强酸溶液反应,又能与强碱溶液反应;工业上电解熔融氧化铝冶炼铝,反应方程式为:2A12O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4A1+3O2↑;氯化铝与氨水反应生成氢氧化铝沉淀与氯化铵,离子反应方程式为:A13++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:铝;既能与强酸溶液反应,又能与强碱溶液反应;2A12O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4A1+3O2↑;A13++3NH3•H2O═Al(OH)3↓+3NH4+;
(4)Mg在空气中燃烧会生成氧化镁、氮化镁,故答案为:Mg;
(5)H、N、O三种元素可以组成酸、碱、盐三类物质,为表中acd三元素,故答案为:acd.
点评 本题考查元素周期表综合应用,是对学生基础知识的综合考查,难度中等.

| A. | ②③④ | B. | ①②③④⑤ | C. | ①②③⑥ | D. | ①②③④ |
| A. | K2CO3 | B. | CH3COONa | C. | NH4Cl | D. | CaCl2 |
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E元素的+3价离子有5个未成对电子 |
| F在周期表的第15列 |
(2)某同学根据上述信息,所画的
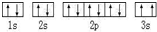 B电子排布图如图,违背了泡利原理.
B电子排布图如图,违背了泡利原理.(3)CD3中心原子的杂化方式为sp3,分子立体构型三角锥形形.
(4)E元素基态原子的电子占用15个原子轨道,有26种不同运动状态.
(5)F元素的元素符号为As,其基态原子的核外电子排布式1s22s22p63s23p63d104s24p3.
| A. | 烷烃 | B. | 烯烃 | C. | 卤代烃 | D. | 炔烃 |
| A. | 向氨水中通入HCl气体,溶液导电性增强 | |
| B. | 向氨水中加入水,$\frac{{C}_{(O{H}^{-})}}{N{H}_{3}•{H}_{2}O}$值增大 | |
| C. | 向氨水中通入NH3,电离度增大 | |
| D. | 向氨水中加入水,Kb不变 |
| A. | CH3COOH═H++CH3COO- | B. | K2SO4═2K++SO42- | ||
| C. | H2CO3?2H++CO32- | D. | Na2CO3?2Na++CO32- |