题目内容
16.体积、pH相同的盐酸(用a表示)与醋酸(用b表示)分别与锌反应:(1)反应过程中平均反应速率:a< b(用>、=或<填空,下同);
(2)与足量的Zn反应产生H2的量:a<b;
(3)生成等量氢气所消耗的Zn:a=b.
分析 盐酸是强酸,属于强电解质,醋酸是弱酸,是弱电解质,醋酸溶液中存在电离平衡,pH和体积相同的盐酸与醋酸溶液中,氢离子浓度相同,醋酸浓度大于盐酸,据此分析.
解答 解:(1)pH相同的盐酸与醋酸溶液中氢离子浓度相同,开始与Zn反应速率相同,随反应进行,醋酸会电离出氢离子,氢离子浓度不盐酸大,反应速率比盐酸快,所以平均反应速率醋酸大于盐酸,故答案为:<;
(2)盐酸是强酸,属于强电解质,醋酸是弱酸,是弱电解质,pH和体积相同的盐酸与醋酸溶液中,氢离子浓度相同,醋酸浓度大于盐酸,所以与足量的Zn反应产生H2的量醋酸大于盐酸,故答案为:<;
(3)Zn无论与盐酸反应还是与醋酸反应,1molZn参加反应生成1mol氢气,所以生成等量氢气消耗相同量的Zn,故答案为:=.
点评 本题考查了强弱电解质的相关知识,注意弱电解质存在电离平衡,题目难度不大.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
6.我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如表:
请回答下列问题:(用A、B、C、D、E,所对应的元素符号作答)
(1)D位于周期表中p区,E的核外电子排布式是1s22s22p63s23p63d104s1
(2)B、C、D第一电离能由大到小为N>O>C
(3)A和C形成的常见分子中,中心原子的杂化方式为sp3
(4)1molABC分子中含有σ键数目为2NA
(5)与化合物BD互为等电子体的阴离子化学式为CN-;
(6)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)D位于周期表中p区,E的核外电子排布式是1s22s22p63s23p63d104s1
(2)B、C、D第一电离能由大到小为N>O>C
(3)A和C形成的常见分子中,中心原子的杂化方式为sp3
(4)1molABC分子中含有σ键数目为2NA
(5)与化合物BD互为等电子体的阴离子化学式为CN-;
(6)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
7.一定条件下,对于含有一定数目分子的气体,决定其体积的主要因素是( )
| A. | 气体分子间的平均距离 | B. | 气体的分子的形状 | ||
| C. | 气体分子本身的大小 | D. | 气体分子的种类 |
4.下列化合物①NaHCO3,②Al(OH)3 ③Al2O3,④H2N-CH2-COOH,⑤(NH4)2CO3,⑥Na2CO3,跟盐酸和氢氧化钠溶液都能反应的是( )
| A. | ②③④ | B. | ①②③④⑤ | C. | ①②③⑥ | D. | ①②③④ |
17.物质的量浓度相同的下列溶液中,含粒子种类最多的是( )
| A. | K2CO3 | B. | CH3COONa | C. | NH4Cl | D. | CaCl2 |
18.在氨水中存在电离平衡:NH3•H20?NH4++OH-,下列说法错误的是( )
| A. | 向氨水中通入HCl气体,溶液导电性增强 | |
| B. | 向氨水中加入水,$\frac{{C}_{(O{H}^{-})}}{N{H}_{3}•{H}_{2}O}$值增大 | |
| C. | 向氨水中通入NH3,电离度增大 | |
| D. | 向氨水中加入水,Kb不变 |
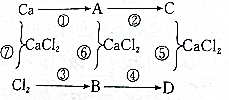
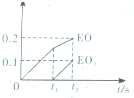 将E单质缓慢通入石灰水中,若生成物中有三种含E元素的离子,其中两种离子的物质的量与反应时间的曲线如图所示,则t1时刻[n(EO-)=0.15mol]消耗氢氧化钙的物质的量为0.15mol,t2时总反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
将E单质缓慢通入石灰水中,若生成物中有三种含E元素的离子,其中两种离子的物质的量与反应时间的曲线如图所示,则t1时刻[n(EO-)=0.15mol]消耗氢氧化钙的物质的量为0.15mol,t2时总反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.