题目内容
10.金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛.(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子.碳元素在周期表中的位置是第二周期第ⅣA族,Q是O,R的电子式为
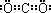 ;
;(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为过滤,除去粗产品中少量钠的试剂为水(或乙醇);
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2.现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,生成氢气的离子方程式为Si+2OH-+H2O═SiO32-+2H2↑,将滤液稀释到1L,若所得Na2SiO3的物质的量浓度为0.17mol•L-1,则SiC的纯度为57%;
(4)下列叙述正确的有②③(填序号)
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
③钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2
④水晶、干冰熔化时克服粒子间作用力的类型相同.
分析 (1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q是O2、R是CO2,在二氧化碳分子中每个O原子和C原子之间能形成两对共用电子对;
(2)将不溶性固体和液体分离通常采用的方法是过滤;Na可以与水(或乙醇)发生反应,金刚石不可以;
(3)Si与氢氧化钠溶液反应生成硅酸钠与氢气;根据n=cV计算Na2SiO3的物质的量,硅酸钠原与Si、二氧化硅与氢氧化钠反应得到,根据Si元素守恒计算二氧化硅物质的量,根据m=nM计算Si、二氧化硅的质量,进而计算SiC的质量,可以计算SiC的纯度;
(4)①Na还原CCl4的反应属于置换反应,但Cl2与H2O反应生成HCl和HClO;
②元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
③钠、锂分别在空气中燃烧,生成的氧化物分别为Na2O2、Li2O.
④二氧化硅属于原子晶体,而干冰属于分子晶体.
解答 解:(1)碳元素在周期表中的位置是:第二周期第ⅣA族,由题给信息“碳与Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子”可推知Q为氧,非极性分子R为CO2,CO2的电子式为 ,
,
故答案为:第二周期第ⅣA族;O;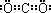 ;
;
(2)金刚石是不溶于CCl4的固体,CCl4是液体,将不溶性固体和液体分离通常采用的方法是过滤;由于Na可以与水(或乙醇)发生反应,而金刚石不与水(或乙醇)反应,所以除去粗产品中少量的钠可用水(或乙醇),
故答案为:过滤;水(或乙醇);
(3)硅与NaOH反应的化学方程式Si+2NaOH+H2O═Na2SiO3+2H2↑,其离子方程式为:Si+2OH-+H2O═SiO32-+2H2↑,反应生成0.1mol氢气,则生成硅酸钠为0.1mol×$\frac{1}{2}$=0.05mol,溶液中硅酸盐的物质的量为0.17mol•L-1×1L=0.17mol,硅酸钠原与Si、二氧化硅与氢氧化钠反应得到,根据Si元素守恒,二氧化硅物质的量为0.17mol-0.05mol=0.12mol,则产品中Si与SiO2的总质量=0.05mol×28g/mol+0.12mol×60g/mol=8.6g,故SiC的质量为20.0g-8.6g=11.4g,则SiC的纯度为$\frac{11.4g}{20g}$×100%=57%,
故答案为:Si+2OH-+H2O═SiO32-+2H2↑;57%;
(4)①Na还原CCl4的反应属于置换反应,但Cl2与H2O反应生成HCl和HClO,不是置换反应,故①错误;
②Na2SiO3溶液与SO3的反应,说明酸性H2SiO3比H2SO4弱,则可用于推断Si与S的非金属性强弱,故②正确;
③钠、锂分别在空气中燃烧,生成的氧化物分别为Na2O2、Li2O,阴阳离子数目比均为1:2,故③正确;
④二氧化硅属于原子晶体,而干冰属于分子晶体,熔化时克服粒子间作用力的类型不相同,故④错误.
故选:②③.
点评 本题综合元素化合物知识,题目难度中等,注意从质量守恒的角度结合反应的化学方程式计算,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. |  含0.01molKOH 和0.01mol Ca(OH)2 的混合溶液中缓慢通入CO2 | |
| B. | 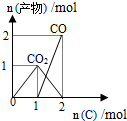 n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物 | |
| C. | 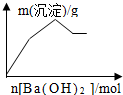 KAl(SO4)2溶液中逐滴加入Ba(OH)2 溶液 | |
| D. | 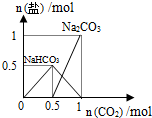 n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐 |
| A. | 维生素A | B. | 维生素B1 | C. | 维生素C | D. | 维生B12 |
| A. | 原子总数相同 | B. | 物质的量相同 | C. | 分子总数相同 | D. | 质量相同 |
| A. | 光导纤维的主要成分为硅单质 | |
| B. | Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同 | |
| C. | Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3 | |
| D. | 制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法 |
| A. | 试管 | B. | 烧杯 | C. | 量筒 | D. | 锥形瓶 | ||||
| E. | 容量瓶 | F. | 玻璃棒 |
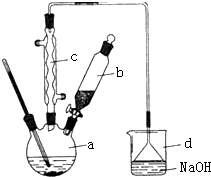 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr;
+HBr;(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体,继续滴加至液溴滴完.装置d装置的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯;要进一步提纯,下列操作中必须的是D(填入正确选项前的字母).
A.重结晶 B.过滤 C.萃取 D.蒸馏.