题目内容
18.(1)相同物质的量的CO2和O2,其分子数之比为1:1,原子数之比为3:2,氧原子数之比为1:1;质量相同的CO2和O2,其物质的量之比为8:11.(2)下列物质属于氧化物的是①⑤(填序号,下同),属于碱的是④,属于酸的是③⑦,属于盐的是②⑥⑧⑨.其中⑥属于纯净物(填“纯净物”或混合物).
①H2O ②NaCl ③H2SO4④Ca(OH)2⑤Fe3O4⑥CuSO4•5H2O ⑦HNO3⑧AgNO3⑨NaHCO3.
分析 (1)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的构成计算;
(2)物质分为混合物和纯净物,纯净物又分为单质和化合物,化合物分为氧化物、酸、碱、盐;由两种或两种以上不同物质组成的物质属于混合物;由两种元素组成且其中一种是氧元素的化合物属于氧化物;电离出的阳离子全部是氢离子的化合物属于酸;电离时产生的阴离子全部是氢氧根离子的化合物属于碱;由金属离子和酸根离子组成的化合物属于盐.
解答 解:(1)由n=$\frac{N}{{N}_{A}}$可知,相同物质的量的CO2和O2,其分子数之比为1:1,原子数之比为3:2,氧原子数之比为1:1;质量相同的CO2和O2,其物质的量之比为$\frac{m}{44}$:$\frac{m}{32}$=8:11,
故答案为:1:1;3:2;1:1;8:11;
(2)①⑤由两种元素组成且其中一种是氧元素,属于氧化物;
④在溶液中电离出钙离子和氢氧根离子,属于碱;
③⑦电离出的阳离子全部是氢离子,属于酸;
②⑥⑧⑨在溶液中电离出的阳离子为金属离子,阴离子为酸根离子,属于盐;
⑥属于纯净物.
故答案为:①⑤;④;③⑦;②⑥⑧⑨;纯净物.
点评 本题综合考查物质的量的计算以及物质的分离,为高频考点,侧重于学生的计算以及概念的理解,注意把握相关计算公式的运用以及相关概念的学习,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
8.现有三组混合液:①乙酸乙酯和碳酸钠溶液;②乙醇和丁醇;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
9.研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )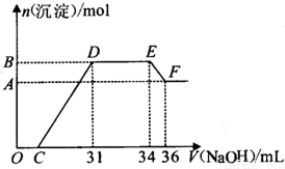

| A. | OC段离子反应方程式为H++OH-═H2O | |
| B. | 溶液中n(NH${\;}_{4}^{+}$)=0.012 mol | |
| C. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ | |
| D. | 欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量 |
3.下列叙述正确的是( )
| A. | 常温常压下,1molCO2的体积是22.4L | |
| B. | 标准状况下1molH2O的体积为22.4L | |
| C. | 标准状况下2molO2的体积约为44.8L | |
| D. | 1molO2和1molN2的体积相等 |
7.设NA表示阿伏加德罗常数的值,下列说法中不正确的( )
| A. | 2克16O2和14N2的混合气中含有的电子数为NA个 | |
| B. | 1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子总数为NA个 | |
| C. | Na2O和Na2O2的混合物中若含有1molNa+,则其含有阴离子总数为0.5NA | |
| D. | 常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
 在溴乙烷与NaOH乙醇溶液的反应中有气体生成.有人设计了如图实验方案,检验生成的气体是否是乙烯.请按照要求填空:
在溴乙烷与NaOH乙醇溶液的反应中有气体生成.有人设计了如图实验方案,检验生成的气体是否是乙烯.请按照要求填空: 尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g) ;
;