题目内容
1. 化学反应原理在科研和生产中有广泛应用:
化学反应原理在科研和生产中有广泛应用:(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)═TaI4(g)+S2(g)△H>0 ( I)
①该反应的平衡常数表达式K=$\frac{c(TaI{\;}_{4})c(S{\;}_{2})}{c{\;}^{2}(I{\;}_{2})}$;
②若K=1,向某恒容密闭容器中加入1.0mol I2(g)和足量TaS2(s),则I2(g)的平衡转化率为66.7%.
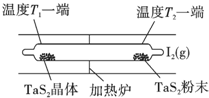
(2)如图所示,反应( I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1<T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是I2.
(3)利用I2的氧化性可测定钢铁中硫的含量.做法是将钢样中的硫转化为 H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为淀粉溶液,滴定反应的离子方程式为H2SO3+I2+H2O=4H++SO42-+2I-.
(4)25°C时,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,所得溶液的pH=7,则c(NH4+)=c(Cl-);a>b.(填“>”、“<”或“=”)
分析 (1))①TaS2(s)+2I2(g)═TaI4(g)+S2(g),该反应的平衡常数表达式K=$\frac{c(TaI{\;}_{4})c(S{\;}_{2})}{c{\;}^{2}(I{\;}_{2})}$,故答案为:$\frac{c(TaI{\;}_{4})c(S{\;}_{2})}{c{\;}^{2}(I{\;}_{2})}$;
②若K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,
根据K=$\frac{c(TaI{\;}_{4})c(S{\;}_{2})}{c{\;}^{2}(I{\;}_{2})}$=$\frac{0.5x×0.5x}{(1-x){\;}^{2}}$计算;
(2)通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2;
(3)因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂;
(4)NH3•H2O+HCl═NH4Cl+H2O,若是等浓度,生成NH4Cl应该呈酸性,而反应后PH=7呈中性,说明NH3•H2O有剩余结合电荷守恒判断.
解答 解:(1)①TaS2(s)+2I2(g)═TaI4(g)+S2(g),该反应的平衡常数表达式K=$\frac{c(TaI{\;}_{4})c(S{\;}_{2})}{c{\;}^{2}(I{\;}_{2})}$,故答案为:$\frac{c(TaI{\;}_{4})c(S{\;}_{2})}{c{\;}^{2}(I{\;}_{2})}$;
②若K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,根据K=$\frac{c(TaI{\;}_{4})c(S{\;}_{2})}{c{\;}^{2}(I{\;}_{2})}$=$\frac{0.5x×0.5x}{(1-x){\;}^{2}}$=1,
解之得:x=66.7%,
故答案为:66.7%;
(2)由所给方程式可知该反应为吸热反应,通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2,I2是可以循环使用的物质;
故答案为:<;I2;
(3)因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂.离子反应:H2SO3+I2+H2O=4H++SO42-+2I-,故答案为:淀粉溶液;H2SO3+I2+H2O=4H++SO42-+2I-;
(4)NH3•H2O+HCl═NH4Cl+H2O,若是等浓度,生成NH4Cl应该呈酸性,而反应后PH=7呈中性,说明NH3•H2O有剩余,所以a>b;根据电荷守恒,则c(NH4+)+c(H+)=c(Cl-)+c(OH-),又PH=7,所以c(NH4+)=c(Cl-),故答案为:=;>.
点评 本题考查化学平衡常数的表达式及其计算,平衡转化率,滴定实验以及溶液中离子浓度的比较等知识,难度较大.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案| A. | “神十”搭载的长二F改进型火箭推进剂是偏二甲肼(C2H8N2)和四氧化二氮,其中四氧化二氮作氧化剂 | |
| B. | 废弃的金属、纸制品、塑料袋、玻璃都是可回收资源 | |
| C. | 2013年1月2日,印度金矿附近村庄出现砷中毒病例,砷中毒与环境污染有关 | |
| D. | 从2012年3月15日起,国家规定食用碘盐中碘含量为20~30 mg•kg-1,加碘盐中的碘以碘化钾形式存在 |
①过量锌与18 mol/L的硫酸反应;
②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量铜与稀硝酸反应;
⑥过量稀硫酸与大块状石灰石反应.
⑦常温下过量的浓硫酸与铝反应.
| A. | ②③⑤ | B. | ②③④⑥⑦ | C. | ①④⑤ | D. | ①②③④⑤ |
| A. | 分子式为C4H10烷烃的二氯取代物 | |
| B. | 分子式为C4H8O2的有机物 | |
| C. | 乙苯的一氯取代物 | |
| D. | 分子式为C3H9N的有机物,其中N原子以三个单键与其他原子相连 |
(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
| 阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
| 阴离子 | NO${\;}_{3}^{-}$ | CO${\;}_{3}^{2-}$ | SiO${\;}_{3}^{2-}$ | SO${\;}_{4}^{2-}$ |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)实验Ⅰ能确定一定不存在的离子是Ag+、Ca2+、Ba2+;
(2)实验Ⅰ中生成气体的离子方程式为CO32-+2H+=H2O+CO2↑;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
| 阴离子 | NO${\;}_{3}^{-}$ | CO${\;}_{3}^{2-}$ | SiO${\;}_{3}^{2-}$ | SO${\;}_{4}^{2-}$ |
| c/mol•L-1 |