题目内容
15.下列分子的价电子模型(VSEPR模型)和分子的模型相同的是( )| A. | NH3 | B. | CO2 | C. | H2O | D. | SO2 |
分析 价层电子对互斥模型(简称VSEPR模型),根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型.
价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;
价层电子对个数为3,不含孤电子对,平面三角形结构;含有一个孤电子对,空间构型为为V形结构;
价层电子对个数是2且不含孤电子对,为直线形结构,据此判断.
解答 解:A.氨气分子中氮价层电子对个数=σ键个数+孤电子对个数=3+(5-3×1)=4,VSEPR模型为正四面体结构,含有一个孤电子对,所以其空间构型为三角锥形,VSEPR模型与分子立体结构模型不一致,故A错误;
B.CO2分子中每个O原子和C原子形成两个共用电子对,价层电子对个数=σ键个数+孤电子对个数=2+(4-2×2)=2,VSEPR模型为直线形结构,且不含孤电子对,所以为直线形结构,VSEPR模型与分子立体结构模型一致,故B正确;
C.水分子中氧原子价层电子对个数=2+×(6-2×1)=4,VSEPR模型为正四面体结构,含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不一致,故C错误;
D.二氧化硫分子中氧原子价层电子对个数=2+×(6-2×2)=3,VSEPR模型为平面三角形结构,含有一个孤电子对,空间构型为为V形结构,VSEPR模型与分子立体结构模型不一致,故D错误;
故选B.
点评 本题考查了价层电子对互斥模型和微粒的空间构型的关系,根据价层电子对互斥理论来分析解答,注意孤电子对个数的计算方法,为易错点,注意实际空间构型要去掉孤电子对为解答关键,题目难度中等.

 精英口算卡系列答案
精英口算卡系列答案| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH2=CH-CH=CH2 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | XeF4 | B. | SF6 | C. | CCl4 | D. | BF3 |
| A. | XH3n | B. | HX | C. | XH2n | D. | H8-3nX |
| A. | NH3 平面三角形 sp3杂化 | B. | CCl4 正四面体 sp3杂化 | ||
| C. | H2O V形 sp2杂化 | D. | CO32- 三角锥形 sp3杂化 |
| A. | 原子半径:F<Mg<K | B. | 稳定性:PH3>H2S>NH3 | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<KOH |

(1)取反应后的“铁块”研碎取样称量,加入如图2装置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温.
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会偏大(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.
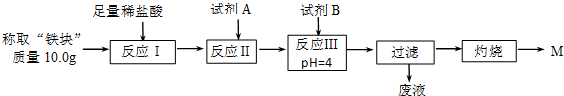
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.