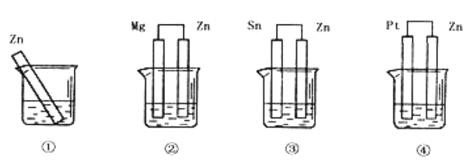
题目内容
【题目】某化学小组需要480 mL 0.1000 mol/L的NaOH溶液。欲在实验室用固体烧碱配制。请回答下列问题:
(1)本实验需用托盘天平称量烧碱的质量为_____g。
(2)配制过程中,不需要的仪器(填写代号)________________。
a.烧杯 b.冷凝管 c.玻璃棒 d.1000mL容量瓶 e.漏斗 f.胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器有药匙、___、___。
(4)请说出本实验中玻璃棒的作用____________。
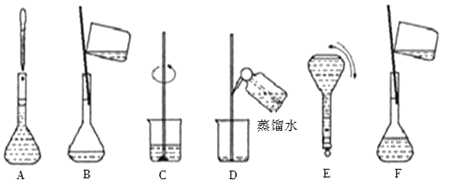
(5)将上图中的实验步骤A~F按实验过程先后次序排列______________。
(6)若配制过程中,其他操作都准确,下列操作能引起浓度偏高的有______(填代号)。
①用来溶解NaOH的烧杯里面有少许水
②未等稀释后的NaOH溶液冷却至室温就转移到容量瓶中
③将NaOH溶液转移到容量瓶时,不小心撒到了外面少许
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
【答案】2.0 bde 托盘天平 500mL容量瓶 搅拌、引流 CBDFAE ②⑦
【解析】
本题考察配制一定的物质的量浓度溶液。
(1)由于没有480mL的容量瓶,需要使用500mL的容量瓶来配制溶液,所以n(NaOH)=500×10-3L×0.1000mol/L=0.05mol,m(NaOH)=0.05mol×40g/mol=2g,由托盘天平称量为2.0g;
(2)配制过程中,不需要使用冷凝管、1000mL容量瓶、漏斗,即bde为合理选项;
(3)由(1)(2)得知,还缺少500mL容量瓶和托盘天平;
(4)玻璃棒的作用有搅拌(溶解NaOH)、引流(转移溶液);
(5)该实验的步骤有:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、贴标签,所以按实验过程先后次序排列为CBDFAE;
(6)①配制好的溶液的体积以容量瓶刻度线为准,烧杯中有少量的水不会影响溶液的体积,所以①对实验结果无影响,①错误;
②NaOH固体遇水放热,未冷却就转移至容量瓶中,定容后溶液体积会变小,所以溶液的浓度会偏高,②正确;
③转移溶液时,洒出会使得NaOH的物质的量减小,所以溶液浓度会偏低,③错误;
④定容时,加水超过刻度线后,用胶头滴管再吸取一部分,会使得NaOH的物质的量减少,所以溶液浓度会偏低,④错误;
⑤转移前容量瓶中有水,并不影响溶液的体积,所以溶液浓度不受影响,⑤错误;
⑥定容摇匀后,发现液面低于刻度线,是因为有少量液体附着在刻度线上方的器壁上,这时不能补加蒸馏水,否则溶液溶度会偏小,⑥错误;
⑦定容时,视线一直盯着刻度线,如果俯视,会造成溶液体积偏小,溶液浓度偏高,⑦正确;
故合理选项为②⑦。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案【题目】向200mLFeCl3与HCl的混合溶液中,分别加入一定量成分均匀的Fe、Cu混合固体,充分反应后剩余固体的质量及放出气体的体积(标准状况下测得)如下表所示。
加入固体质量/g | 9.00 | 18.0 | 27.0 |
剩余固体质量/g | 3.20 | 9.60 | 15.8 |
放出气体体积/L | 0 | 1.12 | 2.24 |
试计算:
(1)原混合液中c(Cl-)=____。
(2)混合固体中n(Fe):n(Cu)=____。