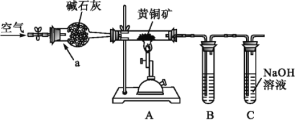
题目内容
【题目】分别放在0.1 molL-1H2SO4溶液中的四块相同的纯锌片,其连接情况如图所示:
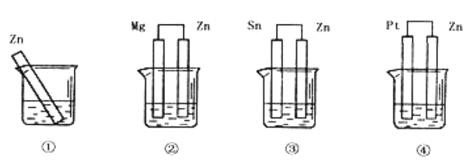
(1)其腐蚀速率由快到慢的顺序是________;
(2)写出②号内正极发生的电极反应式_________;
(3)若③号烧杯内的电解质溶液为NaCl溶液,则Zn电极发生的电极反应式为______。
【答案】④>③>①>② 2H++2e-=H2↑ Zn-2e-+2OH-=Zn(OH)2
【解析】
(1)电化学腐蚀较化学腐蚀快,作原电池负极和电解池阳极的金属加速被腐蚀,作原电池正极和电解池阴极的金属被保护,金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阳极;
(2)②中镁失去电子发生氧化反应,氢离子在正极上得电子发生还原反应生成氢气;
(3)③号烧杯内的电解质溶液为NaCl溶液,放置于空气中较长时间后发生吸氧腐蚀。
(1)金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阳极。①中锌发生化学腐蚀;②中锌作正极加速被保护;③中锌作负极加速被腐蚀;④中锌作负极加速被腐蚀,由于金属活动性Sn>Pt,所以④中电势差比③大,Zn腐蚀速率比③快,所以锌被腐蚀快慢顺序是④>③>①>②;
(2)②中由于Mg活动性比Zn强,Mg作原电池的负极,失去电子发生氧化反应,Zn作正极,在正极Zn上,溶液中的H+得电子发生还原反应生成H2,正极的电极反应式为:2H++2e-=H2↑;
(3)③号烧杯内的电解质溶液为NaCl溶液,放置于空气中较长时间后发生吸氧腐蚀,锌作负极,失去电子,发生氧化反应变为Zn2+,再与溶液中产生的OH-结合形成Zn(OH)2,Zn电极的反应式为:Zn-2e-+2OH-=Zn(OH)2,锡作正极发生还原反应,电极反应式为,O2+2H2O+4e-=4OH-。